Lesedauer: 16 Minuten

Lesedauer: 16 Minuten

Koffein zählt zu den pharmakologisch aktivsten bioaktiven Substanzen des Alltags und entfaltet seine Wirkung primär über die kompetitive Hemmung zentralnervöser Adenosinrezeptoren. Für seine systemische Verstoffwechselung ist nahezu ausschließlich das hepatische Enzym CYP1A2 verantwortlich, das ca. 95 % des Koffeinabbaus katalysiert. Die Aktivität dieses Phase-I-Enzyms unterliegt einer ausgeprägten genetischen Variabilität, insbesondere durch den SNP rs762551, der die Geschwindigkeit des Koffeinmetabolismus maßgeblich beeinflusst. Träger der langsamen Allelvariante (C) weisen eine signifikant verlängerte Plasmahalbwertszeit von Koffein auf, was mit einer verstärkten sympathoadrenergen Stimulation und einem erhöhten Risiko für kardiovaskuläre, neurologische und hormonabhängige Erkrankungen assoziiert ist. In diesem Beitrag werden die funktionellen Eigenschaften des CYP1A2-Enzyms, relevante Genvarianten sowie deren klinische Implikationen im Kontext einer individualisierten Risikobewertung und Prävention detailliert dargestellt.
Koffein, der Hauptwirkstoff in Kaffee, blockiert Adenosinrezeptoren im Gehirn und steigert dadurch Wachheit, Konzentration und Leistungsfähigkeit. Gleichzeitig kann es Blutdruck, Herzfrequenz und den Sympathikus beeinflussen – Effekte, die je nach individueller Verstoffwechselung unterschiedlich stark ausfallen.
Für den Abbau von Koffein ist das Enzym CYP1A2 verantwortlich, das hauptsächlich in der Leber wirkt. Die Aktivität dieses Enzyms ist genetisch bedingt und variiert stark – beeinflusst wird sie vor allem durch den Polymorphismus rs762551 im CYP1A2-Gen.
Langsame Metabolisierer bauen Koffein deutlich langsamer ab. Das verlängert die Wirkung, kann aber auch gesundheitliche Risiken erhöhen – etwa für Bluthochdruck, Herzinfarkt oder hormonbedingte Erkrankungen wie Brustkrebs. Umweltfaktoren wie Medikamente, Rauchen oder Ernährung beeinflussen die Enzymaktivität zusätzlich.
Für die medizinische Praxis ist wichtig, dass bei Patient:innen mit eingeschränktem Koffeinabbau (langsamer CYP1A2-Typ) der Koffeinkonsum individuell angepasst wird. Koffeinfreie Alternativen, eine gezielte Leber- und Entgiftungsunterstützung (z. B. mit aktiven B-Vitaminen, Antioxidantien, Adaptogenen) können helfen, Risiken zu reduzieren und die Wirkung bewusst zu steuern.
Kaffee zählt zu den beliebtesten Getränken weltweit und ist für viele Menschen ein täglicher Begleiter. Neben dem Genuss steht dabei vor allem die anregende Wirkung seines Hauptinhaltsstoffes Koffein im Mittelpunkt. Koffein wirkt als psychoaktive Substanz auf das zentrale Nervensystem, indem es Adenosinrezeptoren blockiert. Das sind Rezeptoren, die normalerweise Signale von Müdigkeit und Erschöpfung vermitteln. Diese Blockade führt zu einer gesteigerten Wachheit, erhöhter Konzentrationsfähigkeit und einem subjektiven Gefühl von Energie und Leistungsbereitschaft. Nach oraler Aufnahme wird Koffein rasch im Magen-Darm-Trakt resorbiert und erreicht innerhalb von 30 bis 60 Minuten die maximale Plasmakonzentration. Aufgrund seiner lipophilen Struktur überwindet es mühelos die Blut-Hirn-Schranke und entfaltet seine Wirkung systemisch, unter anderem durch eine gesteigerte Ausschüttung von Adrenalin, einen kurzfristigen Blutdruckanstieg sowie eine erhöhte Herzfrequenz und Gefäßtonus.
Damit diese Wirkungen nicht übermäßig lange anhalten oder gesundheitlich bedenklich werden, muss Koffein durch körpereigene Entgiftungssysteme wieder abgebaut werden. Dabei übernimmt das Enzym CYP1A2, das zur Familie der Cytochrom-P450-Enzyme gehört, eine zentrale Rolle. CYP1A2 ist hauptsächlich in der Leber aktiv und für den oxidativen Abbau von etwa 95 % des im Körper vorhandenen Koffeins verantwortlich. Die Geschwindigkeit, mit der der Abbauprozess erfolgt, ist jedoch nicht bei allen Menschen gleich. Sie ist genetisch determiniert und wird maßgeblich durch Varianten des CYP1A2-Gens beeinflusst.
Genetisch bedingte Variabilität im Koffeinabbau hat nicht nur Auswirkungen auf die subjektive Verträglichkeit von Kaffee, sondern auch auf das langfristige Gesundheitsrisiko, insbesondere in Bezug auf Herz-Kreislauf-Erkrankungen und Brustkrebs. Studien belegen, dass bei einem schnellen Koffeinabbau ein moderater Kaffeekonsum mit einem geringeren Risiko für koronare Herzkrankheiten, Schlaganfälle und Typ-2-Diabetes assoziiert sein kann. Bei langsamen Abbau hingegen können bereits zwei bis drei Tassen Kaffee pro Tag problematisch sein. Durch die verlängerte Präsenz von Koffein im Blut kommt es zu einer anhaltenden Aktivierung des sympathischen Nervensystems, zu erhöhtem Blutdruck und möglicherweise zu entzündlichen Reaktionen auf Gefäßebene. Eine groß angelegte Studie von Cornelis et al. (2006) zeigte, dass langsame CYP1A2-Metabolisierer bei regelmäßigem Kaffeekonsum ein signifikant höheres Risiko für einen Myokardinfarkt aufweisen, besonders bei Personen unter 50 Jahren. Auch im Zusammenhang mit dem Risiko für hormonabhängige Tumorerkrankungen wie Brustkrebs spielt CYP1A2 eine bedeutsame Rolle. Neben dem Koffeinabbau ist das Enzym auch an der Metabolisierung von Östrogen beteiligt. Ein verlangsamter Abbau kann zu einem hormonellen Ungleichgewicht führen, das möglicherweise das Wachstum hormonrezeptorpositiver Tumoren fördert. Bei prämenopausalen Frauen mit der langsamen CYP1A2-Variante wurde ein erhöhtes Risiko für Brustkrebs in Zusammenhang mit regelmäßigem Kaffeekonsum beobachtet, insbesondere wenn zusätzliche hormonelle oder genetische Risikofaktoren vorlagen. Die Studienlage ist hier zwar komplex, doch der Einfluss des genetischen Profils auf die individuelle Wirkung koffeinhaltiger Substanzen wird zunehmend als klinisch relevant anerkannt. Zusätzlich zur genetischen Komponente kann die Aktivität von CYP1A2 auch durch Umweltfaktoren moduliert werden. Substanzen wie polyzyklische aromatische Kohlenwasserstoffe aus gegrilltem Fleisch oder Nikotin können das Enzym induzieren, während hormonelle Verhütungsmittel oder bestimmte Medikamente wie Fluorchinolone es hemmen können. Diese exogenen Einflüsse verstärken die Notwendigkeit, genetische und umweltbedingte Faktoren gemeinsam zu betrachten, wenn es darum geht, Empfehlungen zum Koffeinkonsum individuell zu gestalten.
Das CYP1A2-Gen (Cytochrom-P450-Familie 1, Subfamilie A, Polypeptid 2) kodiert für das gleichnamige Enzym CYP1A2, das eine zentrale Rolle im Phase-I-Stoffwechsel von Xenobiotika sowie im Metabolismus endogener Substrate spielt. Das Gen befindet sich auf Chromosom 15q24.1 (langer Arm des Chromosoms) und umfasst etwa 7.800 Basenpaare. Das von CYP1A2 codierte Enzym gehört zur Familie der Cytochrom-P450-Monooxygenasen, einer Gruppe von Häm-haltigen Oxidoreduktasen, die für die oxidative Biotransformation zahlreicher Substanzen verantwortlich sind. Die Enzymaktivität von CYP1A2 ist auf die Anwesenheit von Häm als prosthetische Gruppe sowie auf Elektronenübertragung über NADPH und Cytochrom-P450-Reduktase angewiesen. Die Hauptfunktion von CYP1A2 liegt in der Hydroxylierung, N- und O-Dealkylierung und Demethylierung sowie Deaminierung lipophiler Verbindungen, mit dem Ziel, diese wasserlöslicher und damit besser ausscheidbar zu machen. Zu den wichtigsten endogenen Substraten zählen Melatonin, Östrogene, Arachidonsäurederivate und Koffein, während exogene Substrate unter anderem Arzneimittel (z. B. Theophyllin, Clozapin, Olanzapin), Umweltgifte, polyzyklische aromatische Kohlenwasserstoffe (PAK) und heterozyklische aromatische Amine umfassen. Besonders bekannt ist CYP1A2 für den hepatischen Abbau von Koffein, das zu etwa 95 % über dieses Enzym metabolisiert wird.
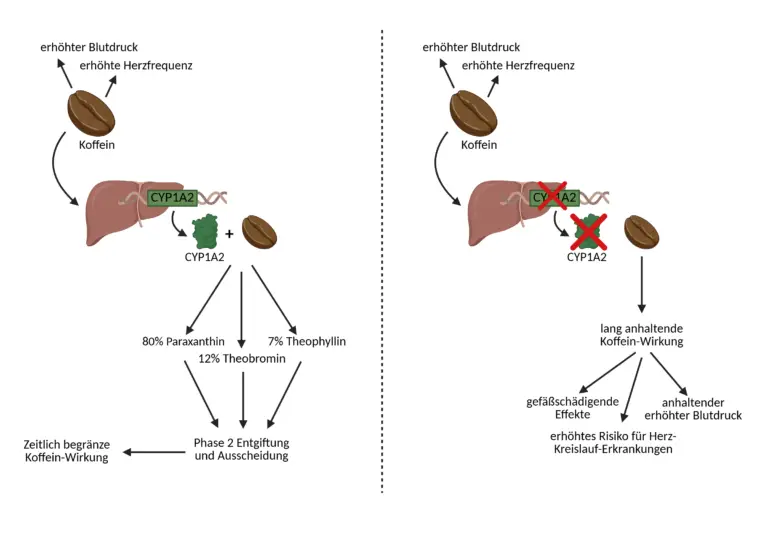
Koffein, auch bekannt als 1,3,7-Trimethylxanthin, wird nach oraler Aufnahme nahezu vollständig im Magen-Darm-Trakt resorbiert und gelangt über die Pfortader in die Leber. Dort wird es primär durch das Enzym CYP1A2 abgebaut, das in der Membran des glatten endoplasmatischen Retikulums der Hepatozyten lokalisiert ist. Für seine Aktivität benötigt CYP1A2 mehrere Cofaktoren: ein zentrales Häm-Fe³⁺, NADPH als Elektronendonator sowie die Cytochrom-P450-Reduktase, die den Elektronentransfer zwischen NADPH und dem aktiven Zentrum des Enzyms vermittelt. Sobald Koffein an das aktive Zentrum von CYP1A2 gebunden ist, wird ein Elektron von NADPH über die Reduktase auf das Häm-Eisen übertragen, wodurch es vom Fe³⁺- in den Fe²⁺-Zustand übergeht. In diesem Zustand kann molekularer Sauerstoff gebunden werden. Ein zweites Elektron reduziert das gebundene O₂-Molekül, woraufhin eines der beiden Sauerstoffatome in das Substrat eingebaut wird, während das andere zu Wasser reduziert wird. Die CYP1A2-katalysierte Reaktion folgt dem Prinzip der Monooxygenasen, wobei lipophile Substrate durch Hydroxylierung, Dealkylierung oder Desaminierung hydrophiler gemacht werden, um im Anschluss ausgeschieden werden zu können. Im Falle von Koffein ist der dominierende Abbauweg die N-Demethylierung, bei der eine der drei Methylgruppen vom Xanthinring entfernt wird. Diese Demethylierung kann an drei verschiedenen Stickstoffpositionen des Koffeinmoleküls stattfinden und führt zur Bildung von drei Hauptmetaboliten: Paraxanthin, Theobromin und Theophyllin. Der wichtigste dieser Abbauwege ist die 3-N-Demethylierung zu Paraxanthin, welche etwa 80 % des gesamten Koffeinabbaus ausmacht. Paraxanthin (1,7-Dimethylxanthin) hat selbst noch biologische Aktivität, unter anderem eine lipolytische Wirkung, wird aber weiter durch Enzyme wie Xanthinoxidase zu 1-Methylxanthin und schließlich zu 1-Methylharnsäure abgebaut, die renal ausgeschieden wird. Ein zweiter Abbauweg führt über die 1-N-Demethylierung zu Theobromin (3,7-Dimethylxanthin), welches etwa 10–12 % des Koffeins umsetzt. Theobromin wirkt leicht diuretisch, gefäßerweiternd und muskelrelaxierend. Auch dieses wird weiter zu Methylxanthin-Metaboliten und schließlich Harnsäureprodukten verstoffwechselt. Der dritte und mengenmäßig kleinste Hauptweg ist die 7-N-Demethylierung zu Theophyllin (1,3-Dimethylxanthin), das etwa 4–7 % des Koffeins ausmacht. Theophyllin hat bronchodilatatorische Eigenschaften und wird auch pharmakologisch als Wirkstoff eingesetzt, insbesondere bei obstruktiven Lungenerkrankungen. Alle drei primären Metaboliten werden in der Folge durch Phase-II-Enzyme wie UDP-Glucuronosyltransferasen oder Sulfotransferasen weiter konjugiert. Diese Konjugationsreaktionen machen die Moleküle wasserlöslich und bereiten sie auf die renale Ausscheidung vor. Die Endprodukte, die überwiegend Methylharnsäurederivate sind, werden über den Urin ausgeschieden.
Der vollständige biochemische Abbauweg von Koffein durch CYP1A2 ist somit ein feinregulierter Prozess, der entscheidend zur Entgiftung beiträgt und stark durch genetische und exogene Einflüsse moduliert wird. Seine Kenntnis ist nicht nur für das Verständnis individueller Koffeinverträglichkeit relevant, sondern auch für die sichere und wirksame Anwendung bestimmter Medikamente, die über denselben metabolischen Weg verstoffwechselt werden.
Damit der Körper Koffein zuverlässig abbauen und potenzielle gesundheitliche Risiken vermeiden kann, ist ein funktionierender Koffeinstoffwechsel entscheidend. Eine Schlüsselrolle in diesem Prozess spielt das Enzym Cytochrom P450 1A2 (CYP1A2), das vom gleichnamigen Gen codiert wird. Seine Hauptaufgabe besteht darin, Koffein in der Leber in verschiedene Metaboliten umzuwandeln – insbesondere in Paraxanthin, Theobromin und Theophyllin. Dieser biochemische Abbau ist notwendig, damit die anregende Wirkung des Koffeins nicht zu lange anhält und der Wirkstoff kontrolliert aus dem Körper ausgeschieden werden kann.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Untersuchung des CYP1A2-Gens (rs762551) festgestellt werden, wie gut dieser Abbauprozess auf individueller Ebene funktioniert. Bei dieser genetischen Variante wird an einer bestimmten Stelle in der DNA die Base Cytosin (C) durch Adenin (A) ersetzt. Diese Veränderung beeinflusst die Genexpression und damit die Menge an produziertem Enzym. Personen mit der Genkonstellation A/A, die rund 41 % der Bevölkerung betreffen, verfügen über die genetisch ursprüngliche Variante. In diesen Fällen wird CYP1A2 in hoher Menge gebildet, sodass Koffein rasch verstoffwechselt werden kann. Der Koffeinspiegel im Blut sinkt schnell, und die Wirkung ist zeitlich begrenzt. Studien zeigen, dass moderater Kaffeekonsum bei diesen sogenannten schnellen Metabolisierern sogar positive Effekte auf die Gesundheit haben kann, etwa ein verringertes Risiko für Herz-Kreislauf-Erkrankungen oder Typ-2-Diabetes, unter anderem durch antioxidative und gefäßaktive Inhaltsstoffe des Kaffees. Bei Träger:innen des A/C oder C/A-Genotyps, der bei etwa 43 % der Bevölkerung vorkommt, liegt auf einem der beiden Allele die beschriebene Veränderung vor. Die Aktivität des Enzyms ist in diesem Fall deutlich reduziert, was dazu führt, dass Koffein langsamer abgebaut wird und länger im Blut verbleibt. Die anregende Wirkung ist dadurch stärker und länger anhaltend. Bei regelmäßigem oder spätem Kaffeekonsum kann es zu unerwünschten Effekten wie Nervosität, Schlafstörungen oder erhöhter Herzfrequenz kommen. Noch relevanter ist jedoch die erhöhte gesundheitliche Risikolage: Langsame Metabolisierer haben vor allem bei Konsum von mehr als zwei Tassen Kaffee pro Tag, ein signifikant erhöhtes Risiko für Herz-Kreislauf-Erkrankungen wie Bluthochdruck oder Herzinfarkt. Bei Frauen wurde zudem ein erhöhtes Brustkrebsrisiko beobachtet, insbesondere wenn gleichzeitig hormonelle Risikofaktoren oder familiäre Vorbelastungen vorliegen. Am deutlichsten ausgeprägt sind die Auswirkungen beim C/C-Genotyp, der bei etwa 16 % der Bevölkerung vorkommt. In diesem Fall liegt die veränderte Genvariante auf beiden Allelen vor, was zu einer besonders stark eingeschränkten CYP1A2-Aktivität führt. Der Koffeinabbau ist hier deutlich verlangsamt, und die Substanz verbleibt sehr lange im Organismus. Die Folge ist eine verstärkte sympathikotone Aktivierung, ein anhaltend erhöhter Blutdruck sowie potenziell gefäßschädigende Effekte. Besonders bei regelmäßigem Kaffeekonsum ist das Risiko für kardiovaskuläre Ereignisse in dieser Gruppe erhöht. Darüber hinaus wurde bei Frauen mit C/C-Genotyp ein überproportional hohes Risiko für hormonabhängige Tumoren wie Brustkrebs beobachtet, was vermutlich mit einer veränderten Wirkung von Koffein auf den Östrogenstoffwechsel zusammenhängt.
Ein verlangsamter Abbau von Koffein kann weitreichende Auswirkungen auf die Gesundheit haben – insbesondere auf das Herz-Kreislauf-System und bei Frauen auch auf das Brustkrebsrisiko. Eine entscheidende Rolle spielt hierbei das CYP1A2-Gen. Genetische Varianten im CYP1A2-Gen, insbesondere die C-Variante, führen dazu, dass Koffein nur verzögert abgebaut wird. Das bedeutet: Nach dem Kaffeekonsum bleibt Koffein länger im Blut und entfaltet seine Wirkung deutlich intensiver und über einen längeren Zeitraum. Studien zeigen, dass Personen mit dieser genetischen Veranlagung ein erhöhtes Risiko für Bluthochdruck, Herzrhythmusstörungen, Herzinfarkt und bei Frauen auch für Brustkrebs haben – vor allem bei regelmäßigem oder übermäßigem Kaffeekonsum. Gerade für genetische Langsam-Metabolisierer ist es deshalb besonders wertvoll, den Koffeinkonsum individuell anzupassen und präventiv gegenzusteuern, nicht durch generellen Verzicht, sondern durch bewusstes Management. Eine angepasste Koffeinstrategie kann zum Beispiel bedeuten, Kaffee oder andere koffeinhaltige Getränke nur in geringen Mengen und bevorzugt vormittags zu konsumieren, um Schlafqualität und Kreislauf zu schonen. Koffeinfreie oder -reduzierte Alternativen wie Getreidekaffee, Lupinenkaffee oder Kräutertees sind gute Optionen. Bei sportlicher Betätigung oder stressreichen Phasen sollte der Koffeinkonsum zusätzlich hinterfragt werden, da hier der Kreislauf ohnehin gefordert ist.
Mikronährstoffe, die die Entgiftungsleistung der Leber und die antioxidative Kapazität des Körpers unterstützen, sind für Menschen mit langsamem Koffeinabbau besonders wertvoll. Dazu zählen vor allem aktive B-Vitamine (B2, B6, B12, Folat), Magnesium, Selen, Vitamin C und E sowie sekundäre Pflanzenstoffe wie OPC, Curcumin oder EGCG aus grünem Tee. Diese Stoffe wirken entzündungshemmend, unterstützen die Phase-I- und Phase-II-Entgiftung und können helfen, potenzielle Nebenwirkungen einer verlängerten Koffeinwirkung abzumildern. Auch der gezielte Einsatz von Adaptogenen wie Rhodiola, Ashwagandha oder Ginseng kann helfen, den Stressstoffwechsel bei sensibler Koffeinverarbeitung zu entlasten.
Darüber hinaus spielt der Lebensstil eine zentrale Rolle: Wer regelmäßig Ausdauersport betreibt, ausreichend schläft, Reizstoffe (wie Alkohol und Nikotin) meidet und für eine ausgewogene Ernährung sorgt, verbessert die allgemeine Stoffwechselleistung und reduziert das Risiko für kardiovaskuläre und hormonell bedingte Erkrankungen.
Wer seine genetische Veranlagung kennt, kann durch gezielte Maßnahmen bewusst gegensteuern und sich dabei nicht einschränken, sondern gesund und individuell stärken. Denn nicht die Menge an Kaffee ist entscheidend, sondern wie gut der Körper damit umgehen kann. Ein Blick auf das CYP1A2-Profil liefert hier wertvolle Orientierung für eine langfristig gesunde und leistungsfähige Lebensweise.
Acta Scientific Medical Sciences. (2024). Caffeine and human health: A biochemical and genetic overview. https://actascientific.com/ASMS/pdf/ASMS-08-1868.pdf
Borchers, M. J., et al. (2022). Association of caffeine intake and cardiovascular events. American Journal of Medicine, 135(12), 1436–1444. https://www.sciencedirect.com
/science/article/pii/S0002916522031355
DocCheck Flexikon. (n.d.). Koffein. https://flexikon.doccheck.com/de/
Koffein
Cornelis, M. C., & El-Sohemy, A. (2007). Coffee, CYP1A2 genotype, and risk of myocardial infarction. JAMA, 297(10), 1135–1141. https://jamanetwork.com/journals/jama/fullarticle/202502
Cornelis, M. C., El-Sohemy, A., & Campos, H. (2006). Genetic polymorphism of CYP1A2 increases the risk of heart disease with coffee consumption. Journal of Nutrition, 136(6), 1596–1603. https://pubmed.ncbi.nlm.nih.gov/16522833/
Fulton, S. L., et al. (2023). CYP1A2 expression and metabolism in liver tissue. bioRxiv. https://www.biorxiv.org/content/10.1101/2023.10.07.561327v1.full.pdf
GB HealthWatch. (n.d.). Caffeine consumption and CYP1A2 gene. https://www.gbhealthwatch.com/Trait-Caffeine-Consumption.php
Hirschhorn, J. N., et al. (2012). Genome-wide meta-analysis identifies multiple loci associated with caffeine intake. Human Molecular Genetics, 21(14), 3283–3291. https://academic.oup.com/hmg/article-abstract/21/14/3283/2385718
International Journal of Molecular Epidemiology and Genetics. (2017). CYP1A2 genetic variation and caffeine metabolism. IJMEG, 8(2), 81–90. https://www.sciencedirect.com/science/article/pii/S1537189117301350
Janssens, A. C., et al. (2012). Clinical validity of CYP1A2 genotyping. Pharmacogenetics and Genomics, 22(12), 915–921. https://www.pharmgkb.org/clinicalAnnotation/1449163934
Julius, C., et al. (2022). CYP1A2 gene and energy metabolism with caffeine. Nutrition & Metabolism, 19, 55. https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/s12986-021-00605-9
Kim, H., et al. (2023). Genetic predictors of caffeine metabolism and health effects. Translational Medicine, 22, Article 132. https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-024-05737-z
PubMed – CYP1A2 Gene. (n.d.). https://pubmed.ncbi.nlm.nih.gov/35905656/
Scalabrin, M., et al. (2012). Caffeine-induced anxiety and CYP1A2. PMC, 3526566. https://pmc.ncbi.nlm.nih.gov/articles/PMC3526566/
Springer Nature. (2024). Functional polymorphisms of CYP1A2 in cancer risk. Molecular Biology Reports. https://link.springer.com/article/10.1007/s11033-024-09800-2
SNPedia. (n.d.). rs762551 (CYP1A2 polymorphism). https://www.snpedia.com/index.php/Rs762551