Lesedauer: 19 Minuten

Lesedauer: 19 Minuten
Vitamin D3 (Cholecalciferol) ist eine prohormonelle Substanz mit weitreichender biologischer Bedeutung, die über den Vitamin-D-Rezeptor (VDR) tief in immunologische, endokrine und zelluläre Regulationsprozesse eingreift. Neben der endogenen Synthese und enzymatischen Aktivierung zu Calcitriol beeinflussen genetische Varianten der beteiligten Enzyme sowie Polymorphismen im VDR-Gen maßgeblich die Bioverfügbarkeit und funktionelle Wirksamkeit. In diesem Beitrag werden die molekularen Mechanismen der Vitamin-D-Signaltransduktion, relevante Genvarianten und deren klinische Relevanz für die personalisierte Substitution erläutert.
Vitamin D3 (Cholecalciferol) wirkt wie ein Hormonvorläufer und kann Immunfunktion, Zellteilung, Entzündungsregulation und psychische Stabilität beeinflussen. Seine aktive Form, 1,25(OH)₂D3 (Calcitriol), reguliert über den intrazellulären Vitamin-D-Rezeptor (VDR) gezielt die Genexpression in zahlreichen Geweben.
Die Umwandlung von Vitamin D3 in seine aktive Hormonform erfolgt über mehrere Enzymschritte (v. a. CYP2R1 und CYP27B1) und hängt stark vom individuellen Stoffwechsel ab. Der Schlüssel zur Wirkung ist der Vitamin-D-Rezeptor (VDR), dessen Effizienz wiederum genetisch bedingt ist – insbesondere durch Polymorphismen wie rs1544410 und rs2228570.
Eine eingeschränkte VDR-Aktivität kann dazu führen, dass Vitamin D3 trotz normaler Blutwerte auf Zellebene nicht ausreichend wirkt. Das kann immunologische, hormonelle oder entzündungsbedingte Beschwerden begünstigen und einen funktionellen Mangel verursachen – auch wenn Laborwerte im Referenzbereich liegen.
Für die medizinische Praxis ist wichtig, dass bei genetisch eingeschränkter VDR-Funktion die Zielwerte für 25(OH)D3 im oberen Normbereich (50–70 ng/ml) liegen sollten. Ergänzend sind Magnesium, Vitamin K2, Zink und Omega-3-Fettsäuren essenziell für die optimale Wirkung. Eine genetisch abgestimmte Vitamin-D3-Therapie ist besonders relevant bei chronischer Entzündung, Erschöpfung, Autoimmunität und hormonellen Dysbalancen.
Vitamin D3, auch Cholecalciferol genannt, ist eine fettlösliche Substanz, die im menschlichen Körper eine Vielzahl an biologischen Funktionen übernimmt und heute vielfach nicht mehr als klassisches Vitamin, sondern als Hormonvorstufe betrachtet wird. Besonders bekannt ist es für seine Rolle im Knochenstoffwechsel, doch tatsächlich beeinflusst Vitamin D3 über die Regulation der Genexpression auch das Immunsystem, die Zellteilung, Entzündungsprozesse, die Muskulatur und sogar die Psyche.
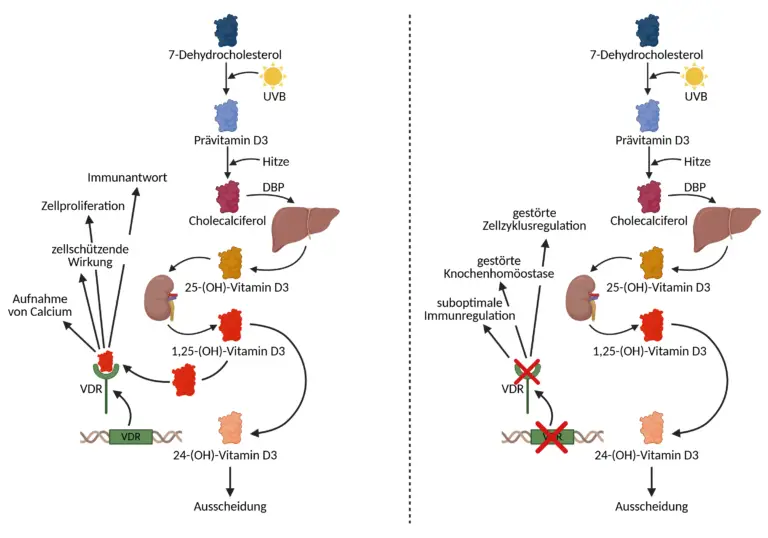
Die körpereigene Synthese von Vitamin D3 erfolgt in der Haut unter Einfluss von Sonnenlicht. Dabei spielt UVB-Strahlung mit einer Wellenlänge zwischen 290 und 315 Nanometern eine zentrale Rolle. In den Zellen der Epidermis ist eine Cholesterin-Vorstufe vorhanden, das sogenannte 7-Dehydrocholesterol. Dieses wird durch UVB-Strahlung photochemisch gespalten und in Prävitamin D3 umgewandelt. Dieser Zwischenstoff ist instabil und wandelt sich durch eine temperaturabhängige Umlagerung spontan in Vitamin D3 (Cholecalciferol) um. Dieser Prozess ist nicht enzymatisch, sondern läuft durch physikalische Reize (Licht und Wärme) ab. Das entstandene Cholecalciferol gelangt anschließend über den Blutkreislauf zur Leber. Im Blut wird es dabei an ein spezielles Transportprotein gebunden, das Vitamin-D-bindende Protein (DBP), das es schützt und löslich macht. In der Leber erfolgt der erste enzymatische Umwandlungsschritt: Hier wird Vitamin D3 durch die 25-Hydroxylase, ein Enzym der Cytochrom-P450-Familie (hauptsächlich CYP2R1), an Position 25 hydroxyliert. Das entstehende Produkt, 25-Hydroxyvitamin D3 (25(OH)D3), ist biologisch noch nicht aktiv, stellt aber die Hauptspeicherform dar. Aufgrund seiner langen Halbwertszeit von etwa zwei bis drei Wochen ist diese Form besonders gut geeignet, um den Vitamin-D-Status im Blut zu beurteilen. Im nächsten Schritt wird 25(OH)D3 in der Niere weiterverarbeitet. In den proximalen Tubuluszellen wird es durch das Enzym 1α-Hydroxylase (CYP27B1) an der Position 1 zusätzlich hydroxyliert. Es entsteht 1,25-Dihydroxyvitamin D3 (1,25(OH)₂D3), auch Calcitriol genannt, die biologisch aktive Hormonform. Diese Form besitzt eine deutlich höhere Wirkung und eine viel kürzere Halbwertszeit als die Speicherform, sie zirkuliert nur in sehr geringen Konzentrationen im Körper. Die Aktivität der 1α-Hydroxylase wird hormonell reguliert, unter anderem durch Parathormon (stimulierend), durch die Calcium- und Phosphatkonzentration im Blut sowie durch den Fibroblast Growth Factor 23 (hemmend). Interessanterweise können auch Immunzellen wie Makrophagen Calcitriol lokal aktivieren, unabhängig von der renalen Steuerung.
Die Wirkung von Calcitriol entfaltet sich auf zellulärer Ebene über einen spezifischen intrazellulären Rezeptor, den Vitamin-D-Rezeptor (VDR). Dieser befindet sich in vielen Zelltypen des Körpers. Nachdem Calcitriol an den VDR gebunden hat, bildet sich ein Komplex mit dem Retinoid-X-Rezeptor (RXR). Dieser Komplex wandert in den Zellkern und bindet dort an bestimmte DNA-Sequenzen, sogenannte Vitamin-D-Response-Elements (VDREs). Dadurch wird die Aktivität zahlreicher Gene reguliert. Unter anderem solche, die für die Aufnahme und den Transport von Calcium, für die Modulation des Immunsystems, für die Zellproliferation, Differenzierung und Apoptose verantwortlich sind. Vitamin D3 hat somit nicht nur eine strukturelle Rolle für den Knochenstoffwechsel, sondern auch eine immunregulatorische, entzündungshemmende und zellschützende Wirkung. Ist der Calcitriol-Spiegel ausreichend hoch oder besteht kein weiterer Bedarf, wird der aktive Metabolit durch das Enzym 24-Hydroxylase (CYP24A1) wieder inaktiviert. Dabei entsteht unter anderem 1,24,25(OH)₃D3, das weiter abgebaut und über Leber und Niere ausgeschieden wird. Dieser Abbauweg stellt sicher, dass eine endogene Überproduktion von Vitamin D3 keine toxischen Effekte verursacht.
Die Funktionsweise dieses gesamten Stoffwechselweges hängt maßgeblich von genetischen Faktoren ab. Individuelle Unterschiede in der Aktivität der beteiligten Enzyme, wie der 25-Hydroxylase, der 1α-Hydroxylase oder der 24-Hydroxylase, sowie in der Struktur und Funktion des Vitamin-D-Rezeptors können die Effizienz der Umwandlung und Wirkung deutlich beeinflussen. Bei genetisch bedingten Einschränkungen kann es trotz scheinbar ausreichender Blutspiegel an 25(OH)D3 zu einer verminderten zellulären Wirkung kommen. In solchen Fällen sind eine engmaschigere Kontrolle sowie eine individualisierte Dosierung sinnvoll, um eine optimale Vitamin-D-Versorgung sicherzustellen.
Das VDR-Gen (Vitamin-D-Rezeptor) kodiert für den gleichnamigen intrazellulären Rezeptor, der eine zentrale Rolle in der Signaltransduktion von Vitamin D3 (Cholecalciferol) spielt. Es ist auf Chromosom 12 an der Position q13.11 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 100.000 Basenpaare mit mehreren Exons, die für unterschiedliche Isoformen des Rezeptors codieren können. Der Vitamin-D-Rezeptor ist ein nukleärer Transkriptionsfaktor aus der Familie der steroidähnlichen Hormonrezeptoren. Nach Bindung der aktiven Vitamin-D3-Form (1,25-Dihydroxycholecalciferol, auch Calcitriol) vermittelt der VDR spezifische Genregulationsprozesse, die sowohl den Kalzium- und Phosphathaushalt als auch zahlreiche immunologische, entzündungshemmende und antiproliferative Mechanismen steuern.
Nach der endogenen Synthese von Calcitriol durch enzymatische Hydroxylierungen in Leber (25-Hydroxylase, CYP2R1) und Niere (1α-Hydroxylase, CYP27B1) diffundiert das lipophile Molekül passiv durch die Zellmembran und bindet im Zytosol an den inaktiven Vitamin-D-Rezeptor. Die Bindung von Calcitriol an den VDR erfolgt über hochaffine, spezifische Interaktionen im Ligandenbindungsdomänen-Komplex, insbesondere durch hydrophobe Wechselwirkungen und Wasserstoffbrücken mit konservierten Aminosäureresten wie Arg274, Ser237 und His397. Diese Interaktion induziert eine Konformationsänderung des Rezeptors, die zum Austausch von Korepressoren (z. B. NCoR, SMRT) gegen Koaktivatoren (z. B. SRC-1, CBP, DRIP) führt. Nach Ligandenbindung bildet der VDR einen Heterodimer mit dem Retinoid-X-Rezeptor (RXR). Dieser Komplex transloziert in den Zellkern, wo er an spezifische DNA-Abschnitte, sogenannte Vitamin-D-Response-Elements (VDREs), in der Promotorregion vitamin-D-abhängiger Gene bindet. VDREs bestehen meist aus zwei Hexameren mit der Konsensussequenz AGGTCA, die als direkt wiederholte Motive (DR3-Typ) mit einem Abstand von drei Basen angeordnet sind. Die Bindung des VDR-RXR-Komplexes an diese Elemente rekrutiert ein Transkriptions-Komplexensemble, das unter Beteiligung von Chromatin-Remodellierungsfaktoren, Histon-Acetyltransferasen und RNA-Polymerase II zur Modulation der Zielgenexpression führt. Die nachgeschalteten Effekte dieser Genregulation sind vielfältig und betreffen zentrale physiologische Prozesse im menschlichen Körper. Im Kalzium- und Phosphatstoffwechsel führt die VDR-Aktivierung zur Hochregulation von Calbindin, TRPV6 und der Plasmamembran-Calciumpumpe in Enterozyten, wodurch die intestinale Kalziumaufnahme signifikant gesteigert wird. In der Niere wird die Reabsorption von Kalzium gefördert, während im Knochengewebe die VDR-vermittelte Regulation von RANKL die Differenzierung von Osteoklasten steuert und somit den Knochenumbau beeinflusst. Im Immunsystem spielt der VDR eine immunmodulierende Rolle, indem er proinflammatorische Zytokine wie Interleukin-6, TNF-alpha oder Interleukin-17 hemmt und gleichzeitig antiinflammatorische Faktoren wie Interleukin-10 oder TGF-beta fördert. Er wirkt hemmend auf die Antigenpräsentation, fördert die Entwicklung regulatorischer T-Zellen und beeinflusst die Reifung von dendritischen Zellen, was insbesondere bei Autoimmunerkrankungen von therapeutischer Bedeutung ist. In Bezug auf Zellproliferation und Apoptose reguliert der VDR zellzyklusinhibierende Gene wie p21 und p27, hemmt Cyclin D1 und kann die Expression proapoptotischer Proteine wie BAX verstärken, während antiapoptotische Faktoren wie BCL-2 unterdrückt werden. Auch Signalwege wie Wnt/β-Catenin oder PI3K/AKT werden über direkte oder indirekte VDR-Interaktionen moduliert, insbesondere in proliferativ aktiven Geweben wie dem Kolonepithel oder Brustdrüsengewebe.
Neben diesen klassischen, genomischen Signalwegen ist zunehmend bekannt, dass der VDR auch nicht-genomische Effekte vermittelt. Diese laufen unabhängig von der DNA-Bindung ab und beinhalten die schnelle Aktivierung zytoplasmatischer Kinasen, Ionentransporter oder second messenger-Systeme. In Zelllinien und primären Geweben wurde beispielsweise gezeigt, dass Calcitriol über den VDR innerhalb von Minuten MAPK-, PKC- oder PI3K-Signalwege aktivieren kann, was etwa zu einer schnellen Modulation von Calciumströmen oder zur Steuerung der Zellmotilität beiträgt.
Ein funktionstüchtiger VDR ist essenziell für die volle Entfaltung der biologischen Wirkung von Vitamin D. Genetische Varianten im VDR-Gen, insbesondere in regulatorischen Regionen, der Ligandenbindungsdomäne oder dem DNA-bindenden Zinkfingerbereich, können die Effizienz der Rezeptoraktivierung und damit die Sensitivität der Zelle gegenüber Calcitriol erheblich beeinflussen. Solche Polymorphismen werden mit einem erhöhten Risiko für Autoimmunerkrankungen, Krebs, Osteoporose, Insulinresistenz und entzündliche Erkrankungen in Verbindung gebracht. Auch epigenetische Modifikationen wie Promotormethylierungen oder Veränderungen in der posttranslationalen Modifikation des Rezeptors (z. B. Phosphorylierung, Acetylierung) beeinflussen die Funktion des VDR erheblich.
Damit Vitamin D3 im Körper seine volle biologische Wirkung entfalten kann, muss es nicht nur in seine aktive Form (1,25-Dihydroxyvitamin D3, Calcitriol) umgewandelt werden, sondern auch effektiv an seinen zellulären Rezeptor binden und über diesen Signalprozesse auslösen. Eine entscheidende Rolle spielt dabei der Vitamin-D-Rezeptor (VDR), ein nukleärer Transkriptionsfaktor, der die Genantwort auf Vitamin D steuert. Das funktionelle Potenzial des VDR wird wesentlich durch seine genetische Ausstattung bestimmt. Besonders relevant sind hierbei zwei häufig untersuchte Genvarianten: rs1544410 und rs2228570, die beide Einfluss auf die Effizienz der Vitamin-D-Signalweiterleitung nehmen können. Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung dieser beiden VDR-SNPs die individuelle Reaktionsfähigkeit auf Vitamin D3 abgeschätzt werden.
Beim SNP rs1544410 kommt es in bestimmten Fällen zu einer Basensubstitution, die zwar keine Aminosäure verändert, aber die Stabilität der VDR-mRNA sowie die Splice-Varianten beeinflussen kann. Diese genetische Variation wird mit einer veränderten VDR-Expression und damit auch mit einer modifizierten Empfindlichkeit der Zellen auf Vitamin D in Verbindung gebracht. Personen mit dem Genotyp C/C, der bei etwa 52 % der Bevölkerung vorkommt, tragen auf beiden Allelen die ursprüngliche, als funktionell günstig geltende Variante. In diesen Fällen wird von einer normalen Rezeptorempfindlichkeit ausgegangen, sodass bei ausreichender Versorgung mit Vitamin D3 eine effektive Genantwort zu erwarten ist. Beim heterozygoten Genotyp C/T oder T/C, der in etwa 37 % der Bevölkerung vorkommt, liegt eine veränderte Basenkonstellation auf einem der beiden Allele vor. Das kann mit einer leicht abgeschwächten Expression oder Funktion des Rezeptors einhergehen. In diesen Fällen kann es vorkommen, dass trotz normaler Blutspiegel von 25(OH)D3 die biologische Wirkung abgeschwächt ist. Betroffenen Personen wird empfohlen, ihre Vitamin-D3-Zufuhr gezielt an die individuelle Situation anzupassen und auf einen optimierten Spiegel von mindestens 50–70 ng/ml zu achten, um eine ausreichende Rezeptorbindung zu gewährleisten. Bei der Genvariante T/T, die etwa 11 % der Bevölkerung betrifft, sind beide Allele verändert. Studien deuten darauf hin, dass in diesen Fällen die VDR-Aktivität deutlich eingeschränkt sein kann, was zu einer verminderten transkriptionellen Antwort auf Calcitriol führt. Diese Personen haben ein potenziell erhöhtes Risiko für eine suboptimale Immunregulation, eine verminderte Wirkung auf den Knochenstoffwechsel und weitere Vitamin-D-abhängige Prozesse. Besonders bei gleichzeitig niedrig-normalen Vitamin-D-Spiegeln kann es zur Unterversorgung auf Zellebene kommen, obwohl Laborwerte unauffällig erscheinen. Betroffenen wird daher eine besonders engmaschige Kontrolle sowie eine gezielte Supplementierung mit Vitamin D3 empfohlen.
Ein zweiter relevanter SNP im VDR-Gen ist rs2228570, auch als FokI-Polymorphismus bekannt. Diese Variante ist funktionell besonders bedeutsam, da sie direkt die Startstelle der Translation betrifft. Durch den Austausch der Base Guanin (G) gegen Adenin (A) wird ein alternatives Startcodon erzeugt, was dazu führt, dass die entstehende VDR-Proteinvariante entweder 3 Aminosäuren kürzer oder länger ist. Diese Veränderung beeinflusst die Rezeptorstruktur und möglicherweise auch die Affinität zu Calcitriol. Beim Genotyp G/G, der bei etwa 47 % der Bevölkerung auftritt, liegt die ursprüngliche, längere VDR-Proteinvariante vor, die als funktionell vollständig beschrieben wird. Diese Form zeigt eine normale Bindungsfähigkeit an Calcitriol und eine physiologisch adäquate Aktivierung der Zielgene, sofern die Versorgung mit Vitamin D3 ausreichend ist. Beim heterozygoten Genotyp G/A oder A/G (ca. 41 % der Bevölkerung) liegt eine gemischte Situation vor: Ein Allel codiert die ursprüngliche, das andere die verkürzte Variante. Studien deuten darauf hin, dass dies zu einer leicht veränderten Rezeptorkinetik führen kann mit potenziell abgeschwächter Transkriptionsantwort auf Calcitriol. Auch hier gilt: Eine stabile Versorgung mit Vitamin D3 sowie eine regelmäßige Kontrolle des Vitamin-D-Spiegels sind empfehlenswert, um mögliche kompensatorische Effekte zu unterstützen. Personen mit dem Genotyp A/A, der bei etwa 12 % der Bevölkerung vorkommt, tragen ausschließlich die verkürzte Proteinvariante. In funktionellen Studien wurde gezeigt, dass diese Form des Rezeptors unter Umständen eine veränderte Ligandenbindung und eine abgeschwächte Aktivierung bestimmter Zielgene aufweist. Das kann zur Folge haben, dass trotz physiologisch normaler Vitamin-D-Spiegel im Blut die zelluläre Antwort reduziert ist. Besonders betroffen sind dabei Prozesse der Immunmodulation, der Zellzyklusregulation und der Knochenhomöostase. Betroffenen Personen wird daher geraten, ihren Vitamin-D-Spiegel in einem oberen Normbereich zu halten und ergänzend auf eine ausreichende Versorgung mit Co-Faktoren wie Magnesium und Vitamin K2 zu achten, um die intrazelluläre Signalweiterleitung bestmöglich zu unterstützen.
Die Analyse des VDR-Gens (Vitamin-D-Rezeptor liefert wertvolle Hinweise darauf, wie effizient der Körper in der Lage ist, das aktive Vitamin D3, also 1,25-Dihydroxycholecalciferol (Calcitriol), auf zellulärer Ebene zu nutzen. Gerade bei Patient:innen mit wiederkehrenden Infekten, chronischen Entzündungen, Autoimmunerkrankungen, Knochenschwäche, anhaltender Erschöpfung oder hormoneller Dysregulation kann die Information aus der VDR-Typisierung gezielt für eine personalisierte Mikronährstoffstrategie genutzt werden. Denn nicht immer sagt ein unauffälliger Vitamin-D-Blutwert etwas über die tatsächliche Wirkung in den Zielzellen aus.
In der Praxis empfiehlt sich bei vorliegender eingeschränkter VDR-Aktivität, etwa bei den Genotypen rs2228570 A/A oder rs1544410 T/T, die gezielte Erhöhung des zirkulierenden 25(OH)D3-Spiegels auf Werte im oberen Normbereich (z. B. 50–70 ng/ml oder mehr, in Rücksprache mit dem Arzt), um trotz verminderter Rezeptorempfindlichkeit eine ausreichende Signalwirkung sicherzustellen. Typische Tagesdosierungen bewegen sich je nach Ausgangswert und Bedarf zwischen 2.000 und 5.000 I.E. Vitamin D3, bei starker genetischer Einschränkung oder chronischer Belastung können auch höhere therapeutische Dosen sinnvoll sein, stets ärztlich begleitet und durch regelmäßige Laborkontrollen ergänzt.
Begleitend sollte auf eine stabile Versorgung mit Magnesium geachtet werden, einem essenziellen Cofaktor für die Aktivierung von Vitamin D3 durch 1α-Hydroxylase und für die Rezeptorbindung im Zellkern. Auch Vitamin K2 spielt eine unterstützende Rolle, insbesondere für die funktionelle Einlagerung von Calcium in die Knochen und den Schutz vor vaskulärer Kalzifizierung. Zusätzlich wichtig sind Zink, Bor und Omega-3-Fettsäuren, die synergistisch auf Immunregulation und Zellmembranstabilität wirken. Neben der Supplementierung ist auch die Lebensweise ein entscheidender Faktor für die Vitamin-D-Wirkung: Regelmäßige Sonnenexposition (mindestens 15–30 Minuten täglich auf Gesicht, Arme und Beine), Bewegung an der frischen Luft, Stressreduktion und eine entzündungsarme Ernährung unterstützen den gesamten Vitamin-D-Stoffwechsel. Besonders förderlich sind Lebensmittel wie fettreicher Fisch (Lachs, Hering, Makrele), Eier, Pilze, Avocado, Nüsse und fermentierte Produkte.
Die genetische Information zum VDR-Status bietet somit eine hervorragende Grundlage, um präventive und therapeutische Maßnahmen exakt auf den biochemischen Bedarf und die zelluläre Verarbeitungskapazität von Vitamin D3 abzustimmen. Besonders im Kontext chronischer Entzündung, Immunerschöpfung, Stimmungsschwankungen oder Hormonungleichgewichten kann eine personalisierte Vitamin-D3-Versorgung auf Basis der VDR-Aktivität ein entscheidender Faktor für Regeneration, Wohlbefinden und langfristige Stabilität sein. Auch für behandelnde Ärzt:innen ergibt sich ein konkreter Mehrwert: klare Handlungsempfehlungen, individuell begründete Dosierungskonzepte und eine hohe Akzeptanz seitens der Patient:innen, die sich kompetent beraten und aktiv eingebunden fühlen.
Burgerstein Vitamine. (n.d.). Vitamin D – Wissenswertes. https://www.burgerstein.at/at/de/wissenswertes/vitamine/vitamin-d
Deutsche Gesellschaft für Ernährung (DGE). (n.d.). Referenzwerte Vitamin D. https://www.dge.de/wissenschaft/referenzwerte/vitamin-d/
DocCheck Flexikon. (n.d.). Calciferol. https://flexikon.doccheck.com/de/Calciferol
Oregon State University, Linus Pauling Institute. (n.d.). Vitamin D. https://lpi.oregonstate.edu/mic/vitamins/vitamin-D
Abbasi, M. et al. (2023). Genetic variations in the vitamin D receptor and susceptibility to disorders. ScienceDirect. https://www.sciencedirect.com/science/article/pii/S0014480023000175
BMC Neurology. (2019). VDR polymorphism and multiple sclerosis in Iranian patients. BMC Neurology, 19, 54. https://bmcneurol.biomedcentral.com/articles/10.1186/s12883-019-1577-y
Frontiers in Immunology. (2021). Vitamin D/VDR signaling and immune response. Frontiers in Immunology, 12, 731565. https://www.frontiersin.org/articles/10.3389/fimmu.2021.731565/full
Genes and Nutrition. (2021). VDR gene-diet interaction in obesity risk. Genes & Nutrition, 16(1), 10. https://genesandnutrition.biomedcentral.com/articles/10.1186/s12263-021-00687-3
Hosseini, B. et al. (2024). Vitamin D receptor polymorphisms and metabolic disorders. Scientific Reports, 14, Article 58561. https://www.nature.com/articles/s41598-024-58561-2
MP Medical Practice. (n.d.). Vitamin D receptor and VDR polymorphisms in chronic disease. https://www.mp.pl/paim/issue/article/15039/
Nikkar, A., et al. (2023). Vitamin D receptor gene polymorphisms and their association with disease risk. RBMB, 41(2), 147–154. https://rbmb.net/article-1-542-fa.html
PLOS ONE. (2022). Association of VDR polymorphisms with autoimmune diseases. PLOS ONE, 17(9), e0275368. https://journals.plos.org/plosone/article?id=10.1371%2Fjournal.pone.0275368
ResearchGate. (n.d.). Primary information for VDR SNPs. https://www.researchgate.net/figure/Primary-information-for-VDR-rs2107301-TC-rs2228570-CT-rs1989969-CT-and-rs11568820_tbl1_316334616
SNPedia. (n.d.). rs1544410 (VDR gene). https://www.snpedia.com/index.php/Rs1544410
SNPedia. (n.d.). rs2107301 (VDR gene). https://www.snpedia.com/index.php/Rs2107301
SNPedia. (n.d.). rs2228570 (FokI, VDR gene). https://www.snpedia.com/index.php/Rs2228570
Subik, D. (2017). Vitamin-D-Rezeptor-Polymorphismen und Immunantworten: Eine populationsbasierte Analyse [Dissertation, Universität Hamburg]. https://ediss.sub.uni-hamburg.de/bitstream/ediss/7674/1/Dissertation.pdf
Zhao, Q. et al. (2024). Vitamin D/VDR gene variants in disease susceptibility. PubMed ID: 38316264. https://pubmed.ncbi.nlm.nih.gov/38316264/