Lesedauer: 7 Minuten

Lesedauer: 7 Minuten

Die Glutathionperoxidase 1 (GPX1) ist ein selenabhängiges Enzym, das eine zentrale Rolle im antioxidativen Schutzsystem des Körpers übernimmt – insbesondere bei der Reduktion von Wasserstoffperoxid und organischen Peroxiden. Ihre Aktivität ist maßgeblich von einer ausreichenden Selenverfügbarkeit sowie von der genetischen Integrität des GPX1-Gens abhängig. In diesem Beitrag beleuchten wir die molekulare Funktion von GPX1, die Auswirkungen genetischer Polymorphismen (rs1050450) auf die Enzymaktivität und den individuellen Selenbedarf, sowie die klinischen Implikationen einer genetisch eingeschränkten ROS-Detoxifikation.
Selen ist ein essentielles Spurenelement, das als Bestandteil der Glutathionperoxidase 1 (GPX1) eine zentrale Rolle beim Schutz vor oxidativem Stress spielt. Es kann helfen, gefährliche freie Radikale wie Wasserstoffperoxid in harmlose Stoffe umzuwandeln und kann somit maßgeblich zum Zellschutz, zur Immunfunktion und zur Schilddrüsengesundheit beitragen.
Das Enzym GPX1 ist selenabhängig – seine Aktivität hängt vom Einbau der Aminosäure Selenocystein ab. Genetische Varianten im GPX1-Gen (z. B. rs1050450) können dazu führen, dass das Enzym weniger wirksam arbeitet und dadurch ein erhöhter Selenbedarf entsteht, um die antioxidative Kapazität aufrechtzuerhalten.
Eine verminderte GPX1-Aktivität kann das Risiko für oxidativen Stress erhöhen, was langfristig zu chronischen Erkrankungen wie Herz-Kreislauf-Problemen, Krebs oder neurodegenerativen Störungen beitragen kann. Besonders betroffen sind Personen mit einer genetisch eingeschränkten Enzymfunktion, die etwa 5 % der Bevölkerung betreffen.
Für die medizinische Praxis ist wichtig, dass bei Patient:innen mit eingeschränkter GPX1-Funktion der Selenstatus regelmäßig überprüft und bei Bedarf durch eine gezielte Supplementierung oder selenreiche Ernährung optimiert wird – insbesondere bei Symptomen wie Infektanfälligkeit, Erschöpfung oder Haarausfall.
Selen ist ein wichtiges Spurenelement, das in unserem Körper für viel Prozesse notwendig ist. Es bietet unteranderem antioxidativen Schutz, unterstütz die Schilddrüsenfunktion und kann durch die entzündungshemmende Wirkung unserem Immunsystem helfen. Der Körper benötigt es nur in sehr geringen Mengen, dennoch kann ein Mangel oder eine Überdosierung erhebliche gesundheitliche Auswirkungen haben.
Verschiedene Substanzen können im Körper als freie Radikale wirken. Unter den freien Radikalen gibt es jedoch eine ganz bestimmte Substanz, das Wasserstoffperoxid, das von den GPX1-Genen neutralisiert werden muss. Bei effektiven Genen wird das Wasserstoffperoxid, das durch die Entgiftung anderer freier Radikale entsteht, sofort von den GPX1-Genen erkannt und in unschädliches Wasser umgewandelt, was zu einem Schutz der Zellen führt. Sind die GPX1-Gene jedoch ineffektiv, dann wird eine besonders hohe Dosis an Selen benötigt, um die Aktivität der beeinträchtigten GPX1-Gene zu fördern und den Schutz wiederherzustellen.
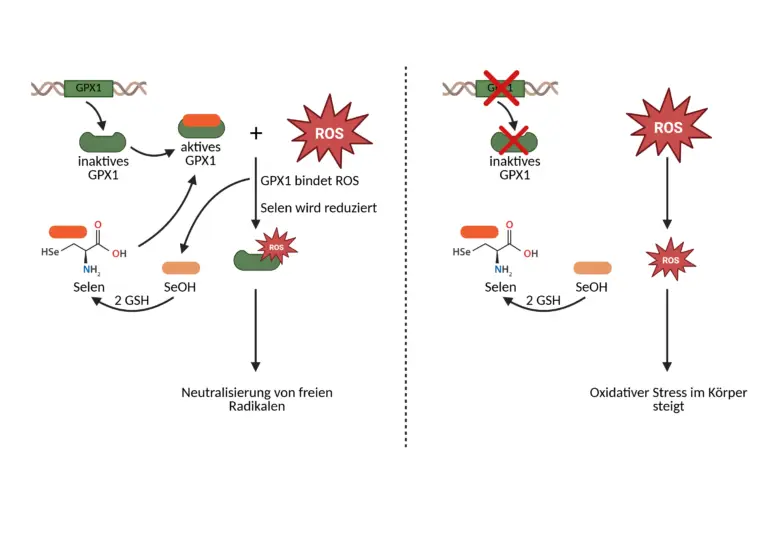
Das GPX1-Gen kodiert für das Enzym Glutathionperoxidase 1. Das Gen befindet sich auf Chromosom 3 an der Position p21.3 (kurzer Arm des Chromosoms) und umfasst etwa 3200 Basenpaare. Das GPX1 ist ein Selenoprotein, das für seine Aktivität auf das Spurenelement Selen angewiesen ist. Selen wird in Form der Aminosäure Selenocystein in das Enzym eingebaut und ist entscheidend für dessen Fähigkeit, reaktive Sauerstoffspezies (ROS), wie Wasserstoffperoxid (H2O2) und organische Peroxide (ROOH), zu neutralisieren und somit oxidativen Stress zu reduzieren. ROS entstehen durch natürliche Stoffwechselprozesse, können aber durch externe Faktoren verstärkt werden. Ein gewisses Maß an ROS ist notwendig für Signalprozesse, Immunabwehr und Anpassungsreaktionen, aber ein Überschuss kann zu oxidativem Stress führen, der Zellschäden verursacht und das Risiko für chronische Krankheiten erhöht.
Ist zu viel H2O2 oder ROOH in unserem Körper, erkennt diese die Glutathionperoxidase 1 und bindet sie als Substrate an ihr aktives Zentrum, das ein Selenocystein-Rest beinhaltet. Das Selenocystein wird durch das Substrat oxidiert (SeOH) und gleichzeitig wird H2O2 zu Wasser (H2O) oder ROOH zu einem Alkohol umgewandelt. Im nächsten Schritt wird mithilfe von 2 reduzierten Glutathion Molekülen (GSH) Elektronen auf das SeOH übertragen und reduzieren es dadurch zurück zum Selenocystein. Als Produkt entsteht hierbei das oxidierte Glutathion GSSG. Abschließend wir das GSSG durch ein anderes Enzym namens Glutathionreduktase mit NADPH wieder in GSH umgewandelt.
Damit reaktive Sauerstoffspezies erfolgreich von unserem Körper durch die Glutathionperoxidase 1 neutralisiert werden können, brauchen wir funktionelle Gene. Liegen jedoch veränderte Basen im GPX1-Gen in der DNA vor kann dies erhebliche Folgen für uns haben. Innerhalb der Genanalysen von NovoMedic kann durch Bestimmung des GPX1-Genotyps (G/G, G/A oder A/A) die genetische Veranlagung der Patienten für die Funktionalität Ihres GPX1-Enzyms analysiert werden. Beim GPX1-Gen wird die Base Guanin durch Adenin ersetzt, was in weiterer Folge die Aminosäure Prolin mit Leucin ersetzt. Diese Veränderung kann zu einer anderen Wechselwirkung zwischen den Aminosäuren führen, wodurch das Enzym falsch gefaltet wird. Bei der Genvariante G/G, die 62% der Bevölkerung tragen, kann das Enzym richtig hergestellt werden und der normale Selenbedarf ist ausreichend für die Aktivität der Glutathionperoxidase 1 und ROS können erfolgreich neutralisiert werden. Beim Genotypen G/A, der zu 33% in unserer Bevölkerung vertreten ist, ist auf einem der zwei vorhandenen Allele eine Base vertauscht. Dadurch wird die Enzymaktivität der Glutathionperoxidase 1 moderat reduziert, was in weiterer Folge einen eingeschränkten ROS-Abbau bewirkt und dadurch der oxidative Stress im Körper steigt. Menschen mit diesem SNP wird geraten mehr Selen zu sich zu nehmen, um die Effizienz des Enzyms zu verbessern. Einen noch höheren Selenbedarf haben Menschen mit der Genvariante A/A, da bei ihnen beide Allele verändert sind und die Aktivität des Enzyms stark reduziert ist. Bei den betroffenen 5% ist der Abbau von Wasserstoffperoxid und organischen Peroxiden deutlich verringert und der oxidative Stress im Körper nimmt zu, der zur Schädigung von DNA, Proteinen und Lipiden führt.
Mit einer Veränderung im GPX1-Gen (rs1050450) kann die körpereigene antioxidative Schutzfunktion beeinträchtigt sein, da das Enzym Glutathionperoxidase 1 (GPX1) eine essenzielle Rolle im Abbau von reaktiven Sauerstoffspezies (ROS) spielt. Dabei ist GPX1 auf das Spurenelement Selen angewiesen, das als Bestandteil des Enzyms direkt an dessen Funktion beteiligt ist.Selen ist nicht nur wichtig für GPX1, sondern auch für die Schilddrüsenfunktion, das Immunsystem und die DNA-Schutzmechanismen. Ein niedriger Selenspiegel kann langfristig zu erhöhtem oxidativem Stress, einer geschwächten Immunabwehr und einem erhöhten Risiko für Krebs, Herz-Kreislauf-Erkrankungen und neurodegenerative Störungen führen. Bereits subklinische Selenmängel können sich durch Müdigkeit, Infektanfälligkeit, brüchige Nägel und Haarausfall bemerkbar machen. In schwereren Fällen können neurologische Symptome, Muskelschwäche oder Störungen der Schilddrüsenfunktion auftreten. Es ist daher entscheidend, Risikogruppen frühzeitig zu identifizieren und eine regelmäßige Kontrolle der Selenwerte durchzuführen. Eine Genanalyse kann dabei helfen, gezielt diejenigen Personen zu erkennen, die eine verminderte GPX1-Aktivität aufweisen und von einer optimierten Selenversorgung profitieren könnten.
Jenen 5% Ihrer Patientengruppe, die statistisch betrachtet aufgrund des ungünstigen Genotyps A/A im GPX1-Gen (rs1050450) eine eingeschränkte Fähigkeit zur Neutralisation von oxidativem Stress aufweisen, ist folgende Vorgehensweise anzuraten:
Eine gezielte Prävention basierend auf der individuellen genetischen Veranlagung kann helfen, oxidative Schäden zu minimieren und das langfristige Gesundheitsrisiko zu senken.
DGE – Deutsche Gesellschaft für Ernährung. (n.d.). Selen – Fragen und Antworten. Retrieved June 2025, from https://www.dge.de/gesunde-ernaehrung/faq/selen/
Estevez, B., et al. (2023). Antioxidant roles of selenium and glutathione peroxidases in metabolic diseases. Molecules, 30(3), 437. https://www.mdpi.com/1420-3049/30/3/437
Gomes, L. M., et al. (2022). Selenium, aging and metabolic disorders: A review. Archives of Endocrinology and Metabolism, 66(3), 351–358. https://www.scielo.br/j/aem/a/RdWCkS8QnmrzYRdvNMqhMRr/?lang=en
Mehdi, Y., et al. (2023). Selenium and human health: The impact of selenium intake on oxidative stress and chronic diseases. Biological Trace Element Research. https://link.springer.com/article/10.1007/s12011-025-04653-7
Qi, Y., et al. (2022). The role of glutathione peroxidase in nutrition and disease. The Journal of Nutritional Biochemistry, 105, 108991. https://www.sciencedirect.com/science/article/pii/S0955286322000471
Steinbrenner, H., & Sies, H. (2013). Selenium homeostasis and antioxidant selenoproteins in brain: Implications for Alzheimer’s disease. Journal of Biological Chemistry, 288(38), 26503–26511. https://www.sciencedirect.com/science/article/pii/S0021925820710847
Yadav, R., et al. (2022). Genetic polymorphisms of selenoproteins and their effect on selenium metabolism. Frontiers in Pharmacology, 13, 1147414. https://pmc.ncbi.nlm.nih.gov/articles/PMC10216560/
Zhang, J., et al. (2022). Role of selenium and selenoproteins in chronic diseases and therapeutic applications. International Journal of Molecular Sciences, 23(12), 6522. https://pmc.ncbi.nlm.nih.gov/articles/PMC9139801/
Brigelius-Flohé, R., & Maiorino, M. (2013). Glutathione peroxidases. Biochimica et Biophysica Acta (BBA) – General Subjects, 1830(5), 3289–3303. https://doi.org/10.1016/j.bbagen.2012.11.020
Gethings, L. A., et al. (2016). Genetic variants in GPX1 affect selenium status and response to selenium supplementation. Food & Function, 7(3), 1501–1509. https://doi.org/10.1039/C5FO01270H
Kohrle, J., Jakob, F., Contempré, B., & Dumont, J. E. (2005). Selenium, the thyroid, and the endocrine system. Endocrine Reviews, 26(7), 944–984. https://doi.org/10.1210/er.2005-0019
Instituto für Präventive Genetik und Diagnostik (IPGD). (n.d.). Glutathionperoxidase 1 (GPX1). Retrieved June 2025, from https://ipgd-labore.de/institut-leistungsspektrum/analysen-a-z/g120/glutathionperoxidase-1/glutathionperoxidase-1.html
MyGeneFood. (n.d.). GPX1 – Mutations & glutathione levels. Retrieved June 2025, from https://www.mygenefood.com/genes/longevity-genes/gpx1/
Na, L., et al. (2014). Selenium and GPX1 gene polymorphisms: implications for disease prevention. Genes & Nutrition, 9, 1–12. https://genesandnutrition.biomedcentral.com/articles/10.1186/s12263-018-0608-4
SNPedia. (n.d.). Rs1050450 (GPX1). Retrieved June 2025, from https://www.snpedia.com/index.php/Rs1050450
Zhao, H., et al. (2012). Association of GPX1 Pro198Leu polymorphism with cancer risk: A meta-analysis. PLoS ONE, 7(9), e45944. https://pmc.ncbi.nlm.nih.gov/articles/PMC3278265/