Lesedauer: 22 Minuten

Lesedauer: 22 Minuten
Homocystein ist ein Zwischenprodukt des Methionin-Stoffwechsels und muss kontinuierlich abgebaut oder remethyliert werden, um zelluläre Schäden zu vermeiden. Eine gestörte Homocysteinregulation kann das Risiko für vaskuläre, neurologische und epigenetisch bedingte Erkrankungen erhöhen. Zwei Schlüsselenzyme im Remethylierungszyklus – Methylen-Tetrahydrofolat-Reduktase (MTHFR) und Methionin-Synthase-Reduktase (MTRR) – steuern die Bereitstellung und Wiederherstellung essenzieller Methylgruppen. Genetische Varianten in diesen Genen können die Aktivität der beteiligten Enzyme beeinträchtigen und zu erhöhten Homocysteinspiegeln führen. Der folgende Beitrag beleuchtet die molekularen Mechanismen der Homocysteinverwertung, die funktionellen Konsequenzen genetischer Polymorphismen und gibt praxisrelevante Empfehlungen für eine gezielte Mikronährstoffunterstützung im Rahmen personalisierter Prävention und Therapie.
Homocystein ist ein kritischer Zwischenmetabolit im Methionin-Stoffwechsel, dessen Konzentration eng kontrolliert werden muss, um vaskuläre, neurologische und epigenetische Schäden zu vermeiden. Die beiden Enzyme MTHFR und MTRR spielen eine Schlüsselrolle in der Remethylierung von Homocystein zu Methionin.
Genetische Varianten in den Genen MTHFR (rs1801133) und MTRR (rs1801394) können die Enzymaktivität reduzieren, was zu erhöhten Homocysteinspiegeln führen kann. Dies begünstigt oxidative Prozesse, Entzündungen und gestörte Methylierung – Risikofaktoren für kardiovaskuläre, neurodegenerative und reproduktive Erkrankungen.
Für die medizinische Praxis ist wichtig, dass bei Vorliegen ungünstiger Genvarianten eine gezielte Versorgung mit bioaktiven Methylspendern wie 5-Methyltetrahydrofolat, Methylcobalamin und ggf. Betain (TMG) erfolgt – ergänzt durch Mikronährstoffe wie B6, Zink und Magnesium.
Homocystein ist eine schwefelhaltige, nicht-proteinogene Aminosäure, die im menschlichen Organismus als zwischenzeitliches Stoffwechselprodukt im Abbauweg der essenziellen Aminosäure Methionin gebildet wird. Methionin selbst wird über die Nahrung aufgenommen und spielt als Methylgruppendonor in Form von S-Adenosylmethionin (SAM) eine zentrale Rolle in zahlreichen biologischen Prozessen. Dazu zählen unter anderem die DNA- und RNA-Methylierung, Neurotransmittersynthese, Phospholipidstoffwechsel und viele epigenetische Regulationsmechanismen. Nach der Abgabe seiner Methylgruppe entsteht aus SAM zunächst S-Adenosylhomocystein (SAH) und anschließend Homocystein.
Da Homocystein reaktiv, potenziell zelltoxisch und biologisch nicht weiter verwertbar ist, muss es in einem eng regulierten Zyklus entweder wieder in Methionin überführt (Remethylierung) oder in den Abbauweg über Cystein eingeschleust werden (Transsulfurierung). Ein dauerhaft erhöhter Homocysteinspiegel, bekannt als Hyperhomocysteinämie, wird mit einer Vielzahl pathophysiologischer Zustände assoziiert. Dazu zählen Endothelschäden, oxidativer Stress, verstärkte LDL-Oxidation und somit ein erhöhtes Risiko für atherosklerotische Erkrankungen, neurodegenerative Prozesse, Depressionen, Schwangerschaftskomplikationen sowie Fehlbildungen beim Fötus. Aus diesem Grund ist die effiziente Regulierung des Homocysteinspiegels ein kritischer Bestandteil des zellulären Gleichgewichts.
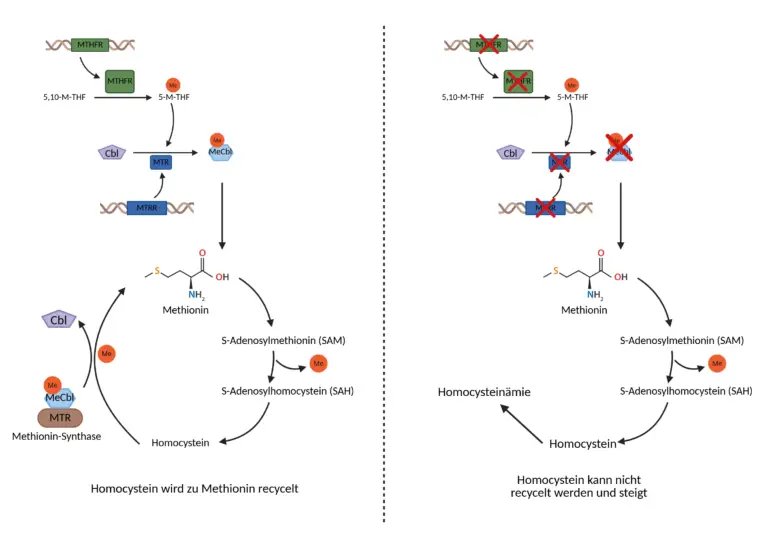
Die Remethylierung von Homocystein zu Methionin stellt dabei den zentralen Entgiftungsweg dar und ist auf eine enge Zusammenarbeit mehrerer Enzyme angewiesen. Zwei davon, Methylen-Tetrahydrofolat-Reduktase (MTHFR) und Methionin-Synthase-Reduktase (MTRR), nehmen hierbei eine Schlüsselrolle ein. Das Enzym MTHFR, kodiert durch das gleichnamige Gen, ist verantwortlich für die Reduktion von 5,10-Methylen-Tetrahydrofolat (5,10-Methylene-THF) zu 5-Methyl-Tetrahydrofolat (5-Methyl-THF). Die einzige Form von Folat, die als Methylgruppendonor in der Homocystein-Remethylierung eingesetzt werden kann. Dieses 5-Methyl-THF liefert die Methylgruppe für die nachfolgende Umwandlung von Homocystein zu Methionin durch das Enzym Methionin-Synthase (MTR), das wiederum den aktiven Vitamin-B12-Cofaktor Methylcobalamin benötigt.
Im Laufe der Reaktion wird Methylcobalamin zu Cobalamin(II) oxidiert, wodurch die Methionin-Synthase deaktiviert wird. Um ihre Aktivität aufrechtzuerhalten, ist eine fortlaufende Regeneration von Methylcobalamin notwendig – genau hier greift die Funktion des MTRR-Gens (Methionin-Synthase-Reduktase) ein. Das von MTRR codierte Enzym regeneriert Methylcobalamin aus der inaktiven, oxidierten Form durch einen NADPH-abhängigen Reduktionsprozess und ermöglicht so die kontinuierliche Funktion der Methionin-Synthase.
MTHFR und MTRR wirken somit als aufeinander abgestimmte Komponenten eines hochregulierten biochemischen Netzwerks. MTHFR liefert die notwendige Methylgruppe in Form von 5-Methyl-THF, MTR übernimmt die eigentliche Methylierung von Homocystein, und MTRR sorgt für die Erhaltung der Enzymaktivität durch die Regeneration des Vitamin-B12-Cofaktors. Diese fein abgestimmte enzymatische Abfolge gewährleistet, dass Homocystein effizient entgiftet und der Methioninspeicher des Körpers aufrechterhalten wird. Ein Ungleichgewicht in diesem System, sei es durch Mikronährstoffmangel, oxidativen Stress oder andere epigenetische Einflüsse, kann den Stoffwechselfluss empfindlich stören und zu einem systemischen Anstieg des Homocysteinspiegels führen. Die Betrachtung der molekularen Zusammenhänge von MTHFR und MTRR liefert daher nicht nur grundlegende Erkenntnisse für die Biochemie des Methylstoffwechsels, sondern eröffnet auch wertvolle Ansatzpunkte für präventivmedizinische und therapeutische Interventionen.
Das MTRR-Gen (Methionin-Synthase-Reduktase) kodiert für das gleichnamige Enzym Methionin-Synthase-Reduktase (MTRR), das eine zentrale Rolle im methylabhängigen Homocystein-Stoffwechsel spielt. Das Gen ist auf Chromosom 5 an der Position p15.31 (kurzer Arm des Chromosoms) lokalisiert und umfasst etwa 14.000 Basenpaare. Die von MTRR codierte Reduktase ist ein Flavoprotein, das für seine Aktivität auf FAD (Flavin-Adenin-Dinukleotid) als prosthetische Gruppe sowie auf das Reduktionsäquivalent NADPH angewiesen ist.
Methionin-Synthase (MTR) katalysiert die Übertragung einer Methylgruppe von 5-Methyl-Tetrahydrofolat (5-Methyl-THF) auf Homocystein, sodass Methionin entsteht. Diese Reaktion ist zentral für die Regulierung von Homocystein und gleichzeitig für die Regeneration von Methionin, das wiederum als Vorstufe für S-Adenosylmethionin (SAM) dient. SAM ist der wichtigste universelle Methylgruppendonor im menschlichen Körper. Damit MTR diese Methylgruppe übertragen kann, benötigt es Vitamin B12 in seiner aktiven Form, Methylcobalamin, als prosthetische Gruppe im aktiven Zentrum. Während der Reaktion gibt Methylcobalamin seine Methylgruppe an Homocystein ab und wird dabei zu Cobalamin(I) reduziert. Diese instabile Zwischenform reagiert sofort mit Wasserstoffionen oder molekularem Sauerstoff und oxidiert zu Cobalamin(II), einer inaktiven Form, in der die Methionin-Synthase ihre Aktivität verliert. Ohne Korrektur wäre der Homocystein-Methionin-Zyklus somit unterbrochen.
Hier kommt die Funktion der Methionin-Synthase-Reduktase (MTRR) ins Spiel: MTRR erkennt das inaktive Cobalamin(II) im Enzymkomplex und reduziert es unter Verbrauch von Elektronen aus NADPH wieder zu Cobalamin(I). Im nächsten Schritt reagiert Cobalamin(I) mit einer Methylgruppe aus 5-Methyl-THF und wird zu Methylcobalamin, wodurch der Methionin-Synthase-Komplex wieder vollständig aktiviert ist. Dieser Zyklus, bestehend aus Aktivierung, Reaktion, Oxidation und Reaktivierung, ist hochdynamisch und läuft in Zellen fortlaufend ab. Die Reaktivierung durch MTRR ist deshalb so essenziell, weil die Methionin-Synthase bei jedem Zyklus seine aktive Cofaktorform verliert und somit dauerhaft auf die „Wartungsfunktion“ durch MTRR angewiesen ist. Ohne die Aktivität von MTRR würde die Methionin-Synthase sukzessive inaktiviert werden, was zu einem Anstieg von Homocystein und einem Rückgang methylierten Vitamin B12 führen würde. Eine Dysfunktion in diesem System führt zu einer Akkumulation von Homocystein, einer Verarmung an SAM, einer Störung des Methylstoffwechsels und kann auch zu neurologischen, vaskulären oder epigenetischen Dysregulationen führen.
Damit Homocystein im Körper erfolgreich zu Methionin remethyliert und somit reguliert werden kann, braucht es eine funktionierende Methionin-Synthase und damit auch ein funktionsfähiges MTRR-Gen. Denn nur wenn das von MTRR codierte Enzym, die Methionin-Synthase-Reduktase, korrekt arbeitet, kann die Methionin-Synthase dauerhaft aktiv gehalten werden. Liegen jedoch veränderte Basen im MTRR-Gen (rs1801394) vor, kann dies erhebliche Auswirkungen auf die Fähigkeit des Körpers haben, Homocystein effizient abzubauen und den Methylstoffwechsel stabil zu halten.
Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung des MTRR-Genotyps (A/A, A/G oder G/A und G/G) die individuelle genetische Veranlagung zur Enzymaktivität der Methionin-Synthase-Reduktase analysiert werden. Beim SNP rs1801394 kommt es zum Austausch der Base Adenin (A) durch Guanin (G). Dies führt zu einer Veränderung in der Aminosäuresequenz: Anstelle von Isoleucin wird an einer zentralen Stelle im Enzym Methionin eingebaut. Dieser scheinbar kleine Austausch kann die dreidimensionale Struktur des Enzyms verändern und damit die Effizienz der Reduktion von oxidiertem Vitamin B12 (Cobalamin) negativ beeinflussen. Bei der Genvariante A/A, die etwa 43 % der Bevölkerung tragen, liegt die ursprüngliche, funktionell intakte Sequenz auf beiden Allelen vor. In diesen Fällen ist die Aktivität der Methionin-Synthase-Reduktase gegeben, sodass der Homocysteinabbau reibungslos funktioniert, wenn ausreichend bioaktive Formen von Folat und Vitamin B12 zur Verfügung stehen. Beim heterozygoten Genotyp A/G oder G/A, der bei etwa 41 % der Bevölkerung vorkommt, ist auf einem der beiden Allele die Base verändert. Dies führt in der Regel zu einer mäßig reduzierten Enzymaktivität, wodurch sich die Fähigkeit zur Regeneration von Methylcobalamin verschlechtern kann. In der Folge läuft die Remethylierung von Homocystein weniger effizient ab. Das kann zu einem leichten bis moderaten Anstieg des Homocysteinspiegels führen, insbesondere bei gleichzeitigem Mangel an Methylcobalamin oder 5-Methyltetrahydrofolat. Betroffenen Personen wird empfohlen, verstärkt auf eine gute Versorgung mit aktiven Vitamin-B12-Formen (z. B. Methylcobalamin) und bioverfügbarem Folat (5-MTHF) zu achten. Bei der Genvariante G/G, die etwa 16 % der Bevölkerung betrifft, sind beide Allele verändert. In diesen Fällen ist die Aktivität der Methionin-Synthase-Reduktase deutlich reduziert. Das bedeutet: Die Methionin-Synthase verliert schneller ihre Funktion, Methylcobalamin kann nicht ausreichend regeneriert werden und Homocystein reichert sich verstärkt im Körper an. Diese Personen haben ein deutlich erhöhtes Risiko für anhaltend hohe Homocysteinwerte, was langfristig zur Beeinträchtigung von Gefäß- und Nervensystem, einer gestörten Methylierungskapazität und damit potenziell zu chronischen Erkrankungen führen kann. Betroffene sollten daher besonders auf eine zielgerichtete Supplementierung mit Methylcobalamin, gegebenenfalls in Kombination mit Betain (TMG) als alternativer Methylgruppenspender, achten.
Das MTHFR-Gen (Methylen-Tetrahydrofolat-Reduktase) kodiert für das gleichnamige Enzym MTHFR, das eine zentrale Rolle im methylabhängigen Homocystein-Stoffwechsel spielt. Das Gen befindet sich auf Chromosom 1 an der Position p36.22 (kurzer Arm des Chromosoms) und umfasst etwa 20.000 Basenpaare. Das von MTHFR codierte Enzym gehört zur Gruppe der Oxidoreduktasen und ist für seine Aktivität auf den Cofaktor FAD (Flavin-Adenin-Dinukleotid) angewiesen.
Die Hauptfunktion der Methylen-Tetrahydrofolat-Reduktase liegt in der Reduktion von 5,10-Methylen-Tetrahydrofolat (5,10-Methylene-THF) zu 5-Methyl-Tetrahydrofolat (5-Methyl-THF). Dieser Reaktionsschritt ist biochemisch hochbedeutend, da 5-Methyl-THF die einzige Form von Folat ist, die im menschlichen Stoffwechsel eine Methylgruppe für die Remethylierung von Homocystein zu Methionin bereitstellen kann. Die Umwandlung wird unter Verbrauch von NADPH als Elektronendonator durchgeführt, wobei FAD als prosthetische Gruppe für die Elektronenübertragung innerhalb des Enzyms notwendig ist. Das gebildete 5-Methyl-THF stellt daraufhin die Methylgruppe für die Reaktion bereit, bei der Homocystein durch das Enzym Methionin-Synthase (MTR) unter Beteiligung von Methylcobalamin (Vitamin B12) zu Methionin umgewandelt wird. Methionin dient anschließend als Substrat für die Bildung von S-Adenosylmethionin (SAM), dem wichtigsten Methylgruppendonor im menschlichen Organismus. SAM wird in über 100 verschiedenen Methylierungsreaktionen benötigt, beispielsweise bei der Methylierung von DNA, RNA, Proteinen, Neurotransmittern, Phospholipiden und Hormonen. MTHFR ist damit ein zentrales Bindeglied zwischen dem Folatstoffwechsel und dem Methylstoffwechsel. Ohne die Aktivität dieses Enzyms kann kein 5-Methyl-THF gebildet werden. In der Folge steht keine Methylgruppe für die Remethylierung von Homocystein zur Verfügung, was dazu führt, dass Homocystein im Blut ansteigt. Gleichzeitig sinken Methionin- und SAM-Spiegel, was sich negativ auf alle Methylierungsprozesse im Körper auswirken kann. Die Aktivität der MTHFR unterliegt einer präzisen Rückkopplungsregulation. Sobald ausreichend SAM im Zellinneren vorhanden ist, wirkt dieses Molekül als negativer Feedback-Inhibitor auf die MTHFR und hemmt deren Aktivität. Damit wird verhindert, dass zu viele Methylgruppen produziert werden, die zu einer Übermethylierung führen könnten. Sinkt der SAM-Spiegel, wird die MTHFR-Aktivität wieder gesteigert, um den Homocysteinabbau und die Methylgruppenbereitstellung zu erhöhen.
Insgesamt ist die Funktion der MTHFR damit essenziell für die Aufrechterhaltung des biochemischen Gleichgewichts zwischen Homocystein, Methionin und SAM. Eine verminderte Aktivität dieses Enzyms führt zu einer gestörten Homocysteinregulierung, einer verminderten Methylierungsleistung und kann sich auf zellulärer Ebene in Form von oxidativem Stress, DNA-Hypomethylierung, gestörter Neurotransmitterbalance oder mitochondrialer Dysfunktion niederschlagen. Die MTHFR ist somit nicht nur ein Enzym des Folatstoffwechsels, sondern ein molekularer Knotenpunkt zahlreicher lebenswichtiger Prozesse im menschlichen Organismus.
Damit der Körper Homocystein zuverlässig in Methionin umwandeln und so in einem gesunden Gleichgewicht halten kann, ist ein funktionierender Folatstoffwechsel entscheidend. Eine Schlüsselrolle in diesem Prozess spielt das Enzym Methylen-Tetrahydrofolat-Reduktase (MTHFR), das vom gleichnamigen Gen codiert wird. Seine Hauptfunktion besteht darin, die Folatform 5,10-Methylen-Tetrahydrofolat in das biologisch aktive 5-Methyltetrahydrofolat (5-MTHF) umzuwandeln – die einzige Form, die dem Körper eine Methylgruppe zur Remethylierung von Homocystein zur Verfügung stellt.
Im Rahmen der genetischen Untersuchungen von NovoMedic kann durch die Analyse des MTHFR-Gens (rs1801133) festgestellt werden, wie gut dieser biochemische Schritt auf individueller Ebene funktioniert. Bei dieser genetischen Variante wird an einer bestimmten Stelle in der DNA die Base Guanin (G) durch Adenin (A) ersetzt. Diese Veränderung hat zur Folge, dass bei der Proteinsynthese statt Alanin die Aminosäure Valin eingebaut wird, was die Struktur und Stabilität des Enzyms beeinflussen kann. Menschen mit der Genkonstellation G/G, die rund 59 % der Bevölkerung betrifft, verfügen über die ursprüngliche Enzymstruktur. In diesen Fällen arbeitet MTHFR in der Regel effizient, sodass ausreichend 5-MTHF gebildet wird und der Homocysteinspiegel stabil gehalten werden kann. Bei Träger:innen des G/A oder A/G-Genotyps (etwa 33 % der Bevölkerung) liegt auf einem der beiden Allele die beschriebene Veränderung vor. Das Enzym arbeitet zwar noch, jedoch etwas weniger effizient. Die Folge kann eine leicht eingeschränkte Verfügbarkeit von 5-MTHF sein, was den Methylierungszyklus insbesondere unter Belastung oder bei gleichzeitig geringem Mikronährstoffstatus ins Stocken bringen kann. Hier empfiehlt sich die bewusste Versorgung mit aktivem Folat (5-MTHF) und Methylcobalamin, um Engpässe zu vermeiden. Deutlich ausgeprägter sind die Auswirkungen beim A/A-Genotyp, der bei rund 8 % der Bevölkerung vorkommt. In diesem Fall sind beide Allele verändert, was zu einer stark reduzierten MTHFR-Aktivität führen kann. Dadurch wird deutlich weniger 5-MTHF gebildet, was die Homocystein-Remethylierung erheblich beeinträchtigt. In der Folge kann es zu einer erhöhten Homocysteinkonzentration im Blut und einer verminderten Bildung von Methionin und S-Adenosylmethionin (SAM) kommen. Solche Störungen können langfristig zu einer erhöhten Anfälligkeit für Gefäß- und Nervenerkrankungen, kognitive Einschränkungen, Störungen der Zellregulation sowie Problemen mit Fruchtbarkeit oder Schwangerschaft beitragen.
Die Kenntnis des MTRR-Genotyps (rs1801394) ermöglicht eine gezielte Auswahl und Dosierung von Nahrungsergänzungsmitteln, insbesondere bioaktive Formen von Vitamin B12 (Methylcobalamin) und Folat (5-Methyltetrahydrofolat). Diese Information ist besonders wertvoll bei Patient:innen mit bereits erhöhten Homocysteinwerten, kardiovaskulären Risikofaktoren oder neurologischen Beschwerden, da in diesen Fällen eine individualisierte Mikronährstoffsupplementierung einen entscheidenden Beitrag zur Prävention und therapeutischen Unterstützung leisten kann. Für Patient:innen mit eingeschränkter MTRR-Aktivität empfiehlt sich die Einnahme von aktivem Vitamin B12 (Methylcobalamin) in Dosierungen zwischen 500 und 3.000 µg pro Tag – je nach genetischem Befund, Laborwerten und klinischer Situation. Ergänzend sollte auch 5-Methyltetrahydrofolat (die bioaktive Form von Folat) zugeführt werden, meist in einer Dosis von 400 bis 800 µg täglich. Vitamin B6 (Pyridoxal-5-Phosphat) unterstützt zusätzlich den alternativen Abbauweg von Homocystein über die Transsulfurierung. Bei deutlich erhöhten Homocysteinwerten kann auch die Supplementierung von Betain (Trimethylglycin) sinnvoll sein – ein alternativer Methylgruppenspender, der unabhängig vom B12-abhängigen Weg wirkt. Auch Zink und Magnesium sollten bei Bedarf ergänzt werden, da sie als Kofaktoren zentraler Enzyme im Methylierungszyklus fungieren.
Neben der Supplementierung spielt auch die Ernährung eine wichtige Rolle. Besonders empfehlenswert sind Vitamin-B12-reiche Lebensmittel wie Fisch (z. B. Lachs, Hering, Makrele), Rindfleisch, Leber und Eier. Folat findet sich in hohen Mengen in dunkelgrünem Blattgemüse (z. B. Spinat, Mangold, Rucola), Brokkoli, Avocado und Hülsenfrüchten. Vitamin B6 ist reichlich enthalten in Walnüssen, Sonnenblumenkernen, Bananen, Kartoffeln und Vollkornprodukten. Gleichzeitig sollte der Konsum stark verarbeiteter Lebensmittel, Transfette, übermäßiger Alkohol sowie Rauchen möglichst vermieden werden, da sie die Funktion des Methylstoffwechsels beeinträchtigen.
Zusammenfassend lässt sich sagen: Die Kombination aus MTRR-Genotypisierung, gezielter Mikronährstoffversorgung, individueller Ernährung und einem gesundheitsfördernden Lebensstil bietet einen äußerst wirkungsvollen, wissenschaftlich fundierten Ansatz für die Prävention und therapeutische Begleitung chronischer Belastungen, insbesondere bei gestörter Homocysteinregulation. Patient:innen profitieren dabei nicht nur durch messbare Verbesserungen in ihren Laborwerten, sondern auch durch gesteigertes Wohlbefinden, mentale Klarheit, verbesserte Stressresistenz und ein langfristig gesünderes Altern. Gleichzeitig ermöglicht diese Herangehensweise eine moderne, verständliche und greifbare Form personalisierter Medizin.
Die Analyse des MTHFR-Gens (rs1801133) liefert wertvolle Hinweise darauf, wie effizient der Körper in der Lage ist, Folat in seine biologisch aktive Form 5-Methyltetrahydrofolat (5-MTHF) umzuwandeln, das ein entscheidender Zwischenschritt im Homocystein-Stoffwechsel. Gerade bei Patient:innen mit einem erhöhten Homocysteinspiegel oder mit chronischen Beschwerden, die mit gestörter Methylierung in Verbindung stehen, etwa kardiovaskuläre Belastungen, Konzentrationsprobleme, depressive Verstimmungen oder unerfüllter Kinderwunsch, kann die genetische Information aus der MTHFR-Typisierung gezielt für eine personalisierte Mikronährstoffstrategie genutzt werden.
In der Praxis empfiehlt sich für Personen mit reduzierter MTHFR-Funktion die gezielte Zufuhr von 5-MTHF – also jener Folatform, die ohne Umwandlung direkt verwertet werden kann. Eine Tagesdosis von 400 bis 800 µg ist in der Regel ausreichend, kann aber bei Bedarf angepasst werden. Begleitend sollte auch auf eine stabile Versorgung mit Methylcobalamin (aktives Vitamin B12) geachtet werden, da dieses als Cofaktor in der Remethylierung von Homocystein unerlässlich ist. Hier liegen die Dosierungen häufig zwischen 500 und 3.000 µg pro Tag, abhängig von der individuellen Ausgangslage. Vitamin B6 ist ebenfalls empfehlenswert, da es den alternativen Abbauweg von Homocystein über die Transsulfurierung unterstützt. Bei stark erhöhten Werten kann zusätzlich Betain (TMG) eingesetzt werden, ein alternativer Methylgruppenspender, der unabhängig vom Folatweg wirkt. Auch Zink und Magnesium sollten mitgedacht werden, da sie als Kofaktoren für mehrere Enzyme im Methylstoffwechsel eine unterstützende Funktion einnehmen. Parallel zur Supplementierung ist auch die Ernährungsweise ein wesentlicher Hebel: Besonders günstig wirken sich Lebensmittel mit natürlichem Folatgehalt aus, etwa grünes Blattgemüse (Spinat, Mangold, Rucola), Brokkoli, Avocados und Hülsenfrüchte. Für eine ausreichende Versorgung mit Vitamin B12 eignen sich gut resorbierbare Quellen wie fetter Fisch, Eier, Leber und Rindfleisch. Vitamin B6 findet sich unter anderem in Bananen, Walnüssen, Sonnenblumenkernen, Kartoffeln und Vollkornprodukten.
Insgesamt bietet die genetische Information zum MTHFR-Status eine hervorragende Grundlage, um präventive und therapeutische Maßnahmen auf den tatsächlichen biochemischen Bedarf abzustimmen. Besonders im Kontext chronischer Belastung, psychischer Erschöpfung oder hormoneller Dysbalancen kann eine personalisierte Mikronährstoffversorgung auf Basis der MTHFR-Aktivität ein entscheidender Faktor für Regeneration, Wohlbefinden und langfristige Gesundheitsstabilität sein. Dabei entsteht auch für die ärztliche Betreuung ein greifbarer Mehrwert: durch klare Handlungsempfehlungen, nachvollziehbare Zusammenhänge und eine hohe Akzeptanz bei den Patient:innen, die sich aktiv in den eigenen Gesundheitsprozess eingebunden fühlen.
Antwerpes, F., & Fink, B. (2024, 21. März). Methioninsynthase. DocCheck Flexikon. Abgerufen am 17. Juni 2025 von https://flexikon.doccheck.com/de/Methioninsynthase
Antwerpes, F., Rezaie, H., & Güler, I. (2024, 21. März). Homocysteinämie. DocCheck Flexikon. Abgerufen am 17. Juni 2025 von https://flexikon.doccheck.com/de/Homocystein%C3%A4mie
El-Ghonaimy, M., El-Deeb, M., El-Ashwah, S., Fouda, M., Al-Adl, M., EL-Sebaie, A. (2024). Association of thrombophilic genes (MTHFR, MTR and MTRR) polymorphisms and homocysteine level in relation to the increased risk of thrombosis among COVID-19 patients. Gene Reports, 37, 102085. https://doi.org/10.1016/j.genrep.2024.102085
Miasko, M. H., Smail, S. W., Karim, A. Y., Qadir, M. K., Bapir, A. A., Omar, S. A., Ismail, I. I., Taha, O. S., Khudhur, Z. O., Jalal, K. F., Mustafa, M. Q., Awla, H. K., Saeed, M., & Safdar, M. (2020). Association study of polymorphisms at A66G (rs1801394) of MTRR gene and autism spectrum disorders in a Kurdish population. Gene Reports, 21, 100949. https://doi.org/10.1016/j.genrep.2020.100949
Montjean, D., Benkhalifa, M., Dessolle, L., Cohen-Bacrie, P., Belloc, S., Siffroi, J. P., Ravel, C., Bashamboo, A., & McElreavey, K. (2011). Polymorphisms in MTHFR and MTRR genes associated with blood plasma homocysteine concentration and sperm counts. Fertility and sterility, 95(2), 635–640. https://doi.org/10.1016/j.fertnstert.2010.08.054
MRes, A. G. B., PhD. (2023b, Oktober 3). MTRR. Gene Food. https://www.mygenefood.com/genes/gastrointestinal-genes/mtrr/?utm_source=chatgpt.com
MTRR 5-methyltetrahydrofolate-homocysteine methyltransferase reductase [Homo sapiens (human)] – Gene – NCBI. (o. D.). https://www.ncbi.nlm.nih.gov/gene?Cmd=DetailsSearch&Db=gene&Term=4552
Ristic, A. (2025, 3. Juni). Blog article – SelfDecode. SelfDecode. https://selfdecode.com/en/blog-article/mtrr-methylation-homocysteine-diet/
rs1801394 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1801394
El-Ghonaimy, M., El-Deeb, M., El-Ashwah, S., Fouda, M., Al-Adl, M., EL-Sebaie, A. (2024). Association of thrombophilic genes (MTHFR, MTR and MTRR) polymorphisms and homocysteine level in relation to the increased risk of thrombosis among COVID-19 patients. Gene Reports, 37, 102085. https://doi.org/10.1016/j.genrep.2024.102085
Fan, Y., Wu, L., & Zhuang, W. (2022). Methylenetetrahydrofolate Reductase Gene rs1801133 and rs1801131 Polymorphisms and Essential Hypertension Risk: A Comprehensive Analysis. Cardiovascular therapeutics, 2022, 2144443. https://doi.org/10.1155/2022/2144443
Methylen-Tetrahydrofolat-Reduktase-(MTHFR)-Mutation – Medizinisch genetisches Zentrum. (o. D.). https://www.mgz-muenchen.de/erkrankungen/diagnose/methylen-tetrahydrofolat-reduktase-mthfr-mutation.html#:~:text=Genetik,Homocysteinwerte%20im%20Plasma%20(Hyperhomocystein%C3%A4mie)
Methylen-Tetrahydrofolat-Reduktase-(MTHFR)-Mutation – Medizinisch genetisches Zentrum. (o. D.). https://www.mgz-muenchen.de/erkrankungen/diagnose/methylen-tetrahydrofolat-reduktase-mthfr-mutation.html#:~:text=Genetik,Homocysteinwerte%20im%20Plasma%20(Hyperhomocystein%C3%A4mie)
Montjean, D., Benkhalifa, M., Dessolle, L., Cohen-Bacrie, P., Belloc, S., Siffroi, J. P., Ravel, C., Bashamboo, A., & McElreavey, K. (2011). Polymorphisms in MTHFR and MTRR genes associated with blood plasma homocysteine concentration and sperm counts. Fertility and sterility, 95(2), 635–640. https://doi.org/10.1016/j.fertnstert.2010.08.054
rs1801133 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1801133
Yakub, M., Moti, N., Parveen, S., Chaudhry, B., Azam, I. & Iqbal, M. P. (2012). Polymorphisms in MTHFR, MS and CBS Genes and Homocysteine Levels in a Pakistani Population. PLoS ONE, 7(3), e33222. https://doi.org/10.1371/journal.pone.0033222
Xiang, T., Xiang, H., Yan, M., Yu, S., Horwedel, M. J., Li, Y., & Zeng, Q. (2020). Systemic risk factors correlated with hyperhomocysteinemia for specific MTHFR C677T genotypes and sex in the Chinese population. Annals of translational medicine, 8(21), 1455. https://doi.org/10.21037/atm-20-6587
Berlin-Potsdam, I. F. M. D. (o. D.-a). 129 Homocysteinämie. https://www.imd-berlin.de/fachinformationen/diagnostikinformationen/homocysteinaemie
Hasan, T., Arora, R., Bansal, A.K. et al. Disturbed homocysteine metabolism is associated with cancer. Exp Mol Med 51, 1–13 (2019). https://doi.org/10.1038/s12276-019-0216-4
Saha, T., Chatterjee, M., Verma, D., Ray, A., Sinha, S., Rajamma, U., & Mukhopadhyay, K. (2018). Genetic variants of the folate metabolic system and mild hyperhomocysteinemia may affect ADHD associated behavioral problems. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 84(Part A), 1–10. https://doi.org/10.1016/j.pnpbp.2018.01.016