Lesedauer: 20 Minuten

Lesedauer: 20 Minuten
Die Omega-3-Fettsäuren Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) beeinflussen den Lipidstoffwechsel auf mehreren Ebenen. Neben ihrer bekannten Wirkung auf Triglyzeridwerte und Entzündungsmarker modulieren sie insbesondere Struktur und Funktionalität des HDL-Cholesterins – einem zentralen Faktor der kardiovaskulären Prävention. Im Zentrum steht dabei das Apolipoprotein A-I (ApoA-I), Hauptbestandteil reifer HDL-Partikel und Schlüsselprotein des Reverse-Cholesterol-Transports. Genetische Varianten im APOA1-Gen können die HDL-Funktion messbar beeinflussen und bestimmen wesentlich, in welchem Ausmaß eine Omega-3-Supplementierung ihre protektive Wirkung entfalten kann. Der folgende Beitrag erläutert die physiologischen Mechanismen, den Einfluss genetischer Polymorphismen und praktische Implikationen für eine personalisierte Mikronährstoffstrategie bei Störungen im HDL-System.
Omega-3-Fettsäuren (EPA & DHA) wirken entzündungshemmend, senken Triglyzeride und können die Funktion von HDL – dem „guten Cholesterin“ – nicht nur mengenmäßig, sondern strukturell und funktional verbessern. Sie fördern die Bildung größerer, stabilerer HDL-Partikel und verbessern den Reverse-Cholesterol-Transport, was vor Herz-Kreislauf-Erkrankungen schützt.
Zentral dabei ist ApoA-I, ein Schlüsselmolekül, das durch das APOA1-Gen codiert wird. Es ist essenziell für die HDL-Reifung, antioxidative Funktion und Cholesterinaufnahme in der Leber.
Bei ungünstiger ApoA-I-Genetik kann Omega-3 jedoch nachteilig wirken (z. B. durch Lipidperoxidation), wenn keine antioxidative Begleitversorgung (z. B. Vitamin E, Q10, Selen) erfolgt.
Für die medizinische Praxis ist wichtig, dass die Kombination aus genetischer Diagnostik, hochwertiger (gegebenenfalls phospholipidgebundener) Omega-3-Supplementierung, gezieltem antioxidativem Schutz sowie einer antiinflammatorisch ausgerichteten Ernährung mit Fisch, Nüssen und Algenölen einen wirkungsvollen Beitrag zur Förderung der kardiovaskulären Gesundheit und metabolischen Balance leisten kann.
Omega-3-Fettsäuren, insbesondere die marinen Formen Eicosapentaensäure (EPA) und Docosahexaensäure (DHA), gehören zu den essenziellen mehrfach ungesättigten Fettsäuren, die der menschliche Organismus nicht selbst herstellen kann und daher über die Nahrung oder gezielte Supplementierung aufnehmen muss. Sie übernehmen eine Vielzahl physiologisch relevanter Funktionen: Sie sind strukturelle Bestandteile von Zellmembranen, beeinflussen die Fluidität und Signalübertragung innerhalb von Zellen, modulieren entzündungsbezogene Genexpressionen und wirken regulierend auf den Lipid- und Lipoproteinstoffwechsel. Insbesondere im Kontext der kardiovaskulären Prävention haben sich EPA und DHA als zentrale Wirkstoffe etabliert, da sie gleich mehrere pathophysiologische Prozesse gleichzeitig adressieren, darunter chronische Entzündung, Dyslipidämie, oxidativen Stress und endotheliale Dysfunktion.
Ein zentrales Zielmolekül der präventiven Wirkung von Omega-3-Fettsäuren ist das High-Density-Lipoprotein, kurz HDL. HDL übernimmt eine zentrale Rolle im Schutz vor Herz-Kreislauf-Erkrankungen. Seine Hauptfunktion besteht im sogenannten Reverse-Cholesterol-Transport, einem biologischen Reinigungsprozess, bei dem überschüssiges Cholesterin aus den Zellen des peripheren Gewebes, vor allem aus den Makrophagen in den Gefäßwänden, zurück zur Leber transportiert wird. Dort wird es verstoffwechselt oder über die Galle ausgeschieden. Neben dieser Transportfunktion wirkt HDL auch entzündungshemmend, antioxidativ und gefäßschützend. Entscheidend dabei ist nicht nur die Menge an HDL im Blut, sondern vor allem die Qualität und Funktionalität der HDL-Partikel. Hier setzt die Wirkung von Omega-3-Fettsäuren an: Sie beeinflussen das HDL-System sowohl strukturell als auch funktionell. Zum einen können EPA und DHA die HDL-Konzentration im Blut leicht erhöhen, typischerweise um etwa 1 bis 5 % bei therapeutischer Dosierung von mindestens 2 bis 4 Gramm pro Tag. Wesentlich bedeutsamer ist jedoch, dass Omega-3-Fettsäuren die Zusammensetzung der HDL-Partikel positiv verändern. Sie fördern die Bildung größerer HDL-Partikel, die besonders effektiv im Cholesterinrücktransport sind, und stabilisieren die Struktur der Partikel, sodass diese ihre antioxidative und entzündungshemmende Wirkung besser entfalten können. Diese strukturellen Veränderungen beruhen unter anderem auf der Modulation wichtiger Enzyme wie der Lecithin-Cholesterin-Acyltransferase (LCAT), die zur Reifung funktioneller HDL-Partikel beiträgt, sowie der hepatischen Lipase, die den Umbau kleiner, ineffizienter HDL3- in größere HDL2-Partikel ermöglicht. Darüber hinaus verbessern Omega-3-Fettsäuren die Aufnahme des rücktransportierten Cholesterins in der Leber durch Erhöhung der Expression des SR-B1-Rezeptors, einer entscheidenden Endstation im Reverse-Cholesterol-Transport.
Darüber hinaus spielt auch der Einfluss von Omega-3 auf die Triglyzeridwerte eine wichtige Rolle im HDL-Stoffwechsel. Hohe Triglyzeridspiegel führen zu einem verstärkten Austausch von Triglyzeriden gegen Cholesterin zwischen HDL und VLDL über das Enzym CETP, was HDL-Partikel destabilisieren und in ineffektive Formen überführen kann. Durch die ausgeprägte Triglyzeridsenkung (−15 bis −30 %) stabilisieren Omega-3-Fettsäuren indirekt auch das HDL-Profil und fördern die Bildung funktionsstarker HDL-Strukturen.
Nicht zuletzt zeigen genetische Studien, dass Menschen mit bestimmten Polymorphismen im CETP-, LCAT- oder ApoA1-Gen besonders gut auf eine Omega-3-Supplementierung ansprechen, etwa durch kompensatorische Enzymmodulation oder stabilere HDL-Bildung. Insgesamt zeigt sich: Omega-3-Fettsäuren leisten einen vielschichtigen Beitrag zur Stabilisierung und funktionellen Optimierung von HDL. Sie wirken nicht nur auf die Konzentration, sondern vor allem auf die Qualität, Aktivität und Schutzwirkung dieses zentralen Lipoproteins und stellen damit einen wichtigen Baustein in der modernen Präventionsmedizin dar.
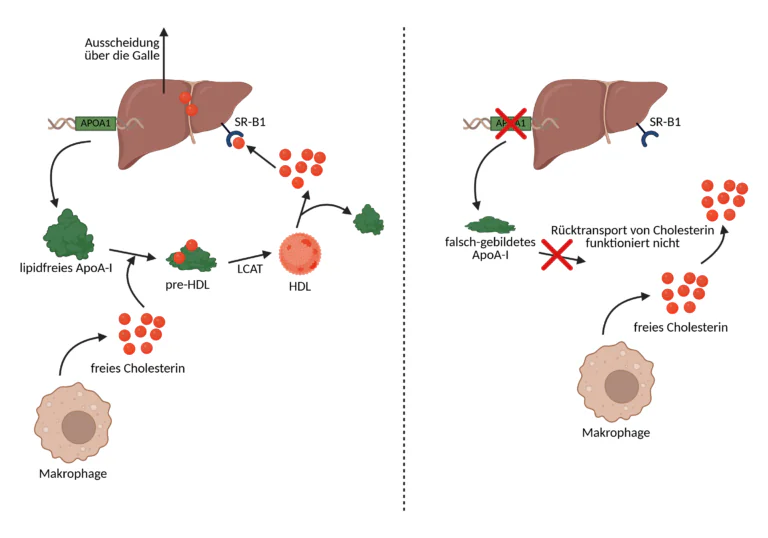
Das APOA1-Gen (Apolipoprotein A1) kodiert für das Apolipoprotein A-I und spielt damit eine essenzielle Rolle im Lipidstoffwechsel, da das Protein ein bedeutender Bestandteil des guten HDL-Cholesterins ist. Das APOA1-Gen befindet sich auf Chromosom 11 an der Position 11q23 (langer Arm des Chromosoms) und erstreckt sich über knapp 2700 Basenpaare. Biochemisch betrachtet beginnt der HDL-Bildungsprozess mit der Synthese und Sekretion von ApoA-I in Leber und Dünndarm. Nach der Freisetzung in den Blutkreislauf liegt es zunächst in lipidfreier oder lipidarmer Form vor und bindet bevorzugt an den Cholesterintransporter ABCA1 auf Zellmembranen. Diese Interaktion ermöglicht die Aufnahme von Phospholipiden und freiem Cholesterin aus den Zellen in das ApoA-I-Molekül, wodurch erste, scheibenförmige HDL- entstehen. Im nächsten Schritt aktiviert ApoA-I das Enzym Lecithin-Cholesterin-Acyltransferase (LCAT), das freies Cholesterin in Cholesterinester umwandelt. Diese wandern in das Partikelinnere und verwandeln das flache HDL-Vorläuferpartikel in eine kugelförmige, reife HDL-Struktur. Diese Reifung ist entscheidend für die Fähigkeit von HDL, Cholesterin aus peripheren Geweben aufzunehmen und zur Leber zurückzuführen. Ein Prozess, der als Reverse-Cholesterol-Transport bezeichnet wird und eine der wichtigsten antiatherogenen Funktionen im menschlichen Organismus darstellt. Reife HDL-Partikel binden über ApoA-I an den hepatischen Scavenger-Rezeptor SR-B1, der die selektive Aufnahme von Cholesterinestern in die Leber ermöglicht, während ApoA-I häufig wiederverwendet wird, um erneut am Zyklus teilzunehmen.
Kommt es jedoch zu Störungen in der Funktion des APOA1-Gens, etwa durch genetische Polymorphismen, oxidativen Schaden oder epigenetisch bedingte Expressionsminderung, kann die gesamte HDL-Wirkungskaskade empfindlich gestört sein. Ein Fehlen oder eine strukturelle Fehlfaltung von ApoA-I führt dazu, dass HDL-Partikel nicht korrekt gebildet werden können, die Aktivierung von LCAT ausbleibt und der Rücktransport von Cholesterin zum Erliegen kommt. Gleichzeitig geht die Stabilisierung antioxidativer Enzymsysteme verloren, wodurch HDL seine Schutzfunktion einbüßt und sogar in eine dysfunktionale, entzündungsfördernde Form übergehen kann. Diese Veränderungen erhöhen das Risiko für kardiovaskuläre Erkrankungen, beeinträchtigen die metabolische Homöostase und verringern die Ansprechbarkeit auf therapeutische Maßnahmen. Vor diesem Hintergrund rückt auch die Rolle von Omega-3-Fettsäuren in ein neues Licht. EPA und DHA gelten gemeinhin als protektiv wirksam, da sie entzündungshemmend, triglyzeridsenkend und HDL-funktionserhaltend wirken. Sie verbessern die Stabilität von HDL-Partikeln und steigern indirekt die LCAT-Aktivität. Diese Effekte setzen jedoch voraus, dass ApoA-I in ausreichender Menge und funktioneller Form vorliegt. Bei gestörter ApoA-I-Funktion können die positiven Effekte von Omega-3 abgeschwächt oder wirkungslos sein, da der HDL-Zyklus nicht vollständig ablaufen kann. Trotz Omega-3-Gabe entstehen dann zwar HDL-Vorläufer, diese können aber nicht zu reifen, cholesterinreichen HDL-Partikeln heranreifen, da die enzymatische Aktivierung durch ApoA-I fehlt. Der Lipidtransport bleibt ineffizient, die antioxidative Kapazität unzureichend und die Schutzwirkung auf die Gefäßwände begrenzt.
Bei sehr hoher Zufuhr von Omega-3-Fettsäuren, insbesondere in Form konzentrierter Fischölpräparate kann dieser Ungleichgewichtszustand problematisch werden. In Abwesenheit einer ausreichenden HDL-Funktion kann ein Überangebot an ungesättigten Fettsäuren zu erhöhter Lipidperoxidation führen, insbesondere wenn gleichzeitig ein Mangel an antioxidativen Kofaktoren wie Vitamin E, Selen oder Q10 vorliegt. Darüber hinaus kann es durch die Wirkung von Omega-3 auf die Thrombozytenaggregation zu einer erhöhten Blutungsneigung kommen, insbesondere bei Personen mit ohnehin gestörter Gefäßbarriere oder gerinnungsaktiver Medikation. Auch die CETP-vermittelte Umverteilung von Cholesterin und Triglyzeriden zwischen HDL und anderen Lipoproteinen kann bei unzureichender HDL-Stabilität aus dem Gleichgewicht geraten und so paradoxerweise eine proatherogene Lipoproteinverteilung fördern.
Die Aktivität und Funktionalität dieses Proteins werden maßgeblich durch die genetische Struktur des APOA1-Gens bestimmt. Besonders gut untersucht ist dabei der Einzelnukleotid-Polymorphismus rs670, bei dem entweder ein Thymidin (T) oder ein Cytosin (C) an einer bestimmten Position vorliegt. Diese genetische Variation beeinflusst die Expression und damit die Konzentration von ApoA-I im Blut sowie die Zusammensetzung und Schutzfunktion der HDL-Partikel. Im Rahmen der Genanalysen von NovoMedic kann anhand dieses Polymorphismus eine Einschätzung darüber getroffen werden, wie effizient das HDL-System eines Menschen arbeitet, insbesondere im Hinblick auf Cholesterinrücktransport, antioxidativen Schutz und entzündungsmodulierende Wirkung.
Rund 4 % der Bevölkerung tragen die T/T-Variante, also die homozygote Ausprägung des genetischen Ursprungsallels. Diese Konstellation ist mit einer besonders günstigen Funktionalität des ApoA-I assoziiert. Studien zeigen, dass diese Genvariante mit einer höheren Expression von ApoA-I, einer verbesserten HDL-Struktur sowie einer gesteigerten antioxidativen Kapazität verbunden ist. Die Träger dieser Variante profitieren daher in der Regel von einer effizienten Cholesterinrückführung, stabilen HDL-Partikeln und einer gut funktionierenden endothelialen Schutzbarriere. Etwa 30 % der Menschen tragen die heterozygote T/C oder C/T-Variante, bei der ein funktionell aktives T-Allel mit einem C-Allel kombiniert ist. Auch diese Konstellation geht mit einem positiven Einfluss auf die HDL-Funktion einher, wenngleich etwas abgeschwächter als bei T/T-Träger:innen. Die ApoA-I-Spiegel im Blut sind in der Regel leicht erhöht oder im oberen Referenzbereich, und die antioxidative HDL-Funktion bleibt weitgehend erhalten. Für die Mehrheit dieser Personen ist keine spezifische Intervention notwendig, allerdings können bei erhöhtem oxidativem Stress, Insulinresistenz oder anderen metabolischen Belastungen gezielte Mikronährstoffstrategien sinnvoll sein, um das genetische Potenzial optimal zu unterstützen. Die häufigste Variante, die bei rund 66 % der Bevölkerung vorkommt, ist die homozygote C/C-Variante. Sie ist mit einer verminderten ApoA-I-Expression und damit einer potenziell eingeschränkten HDL-Funktion verbunden. Studien zeigen, dass bei diesen Personen niedrigere HDL-Spiegel, eine reduzierte antioxidative Kapazität und eine schwächere Aktivierung HDL-assoziierter Schutzenzyme wie Paraoxonase-1 auftreten können. Das Risiko für eine funktionelle HDL-Schwäche ist dadurch , insbesondere bei gleichzeitigem Lebensstilstress, hoher Triglyzeridbelastung oder entzündlichen Prozessen. In diesen Fällen kann es sinnvoll sein, gezielt auf eine Mikronährstoffintervention zur Stabilisierung der HDL-Funktion zu setzen
Insgesamt erlaubt die genetische Analyse des APOA1-Gens eine personalisierte Einschätzung des individuellen HDL-Funktionspotenzials. Während Träger:innen der T/T- und T/C-Variante in der Regel von einer stabilen HDL-Physiologie profitieren, benötigen C/C-Träger:innen unter Umständen gezielte Unterstützung, um ihre kardiovaskuläre Schutzfunktion langfristig aufrechtzuerhalten, insbesondere in Belastungssituationen oder bei vorbestehenden Risikokonstellationen.
Die Kenntnis des individuellen APOA1-Genotyps bietet eine wertvolle Grundlage für eine präzise und personalisierte Mikronährstoffstrategie, insbesondere im Hinblick auf den gezielten Einsatz von Omega-3-Fettsäuren. Ungesättigte Fettsäuren wie DHA (Docosahexaensäure) und EPA (Eicosapentaensäure) sind essenziell für den menschlichen Organismus. Sie übernehmen wichtige strukturelle und regulatorische Aufgaben im zentralen Nervensystem, tragen zum Erhalt der normalen Sehkraft bei, unterstützen die Herzfunktion, wirken entzündungshemmend und spielen eine Rolle in der Regulation der Blutgerinnung.
Ein Mangel an Omega-3-Fettsäuren kann weitreichende Auswirkungen haben, dazu zählen unter anderem Sehstörungen, kardiovaskuläre Risikokonstellationen, neurokognitive Beeinträchtigungen, Hyperaktivität, erhöhte Infektanfälligkeit und chronische Entzündungsprozesse. Besonders kritisch wird ein unzureichender Omega-3-Status bei bestehender genetischer Prädisposition im APOA1-Gen: Denn ApoA-I, das vom APOA1-Gen codierte Hauptprotein des HDL, ist nicht nur für die Struktur, sondern auch für die Funktionalität und antioxidative Kapazität des HDL-Cholesterins verantwortlich und damit eng mit der biologischen Wirkung von Omega-3-Fettsäuren verknüpft.
ApoA-I aktiviert HDL-assoziierte Enzyme, stabilisiert die Lipidmembranstruktur, unterstützt den Cholesterinrücktransport und bindet an spezifische Rezeptoren in der Leber zur finalen Cholesterinaufnahme. Liegt eine genetisch bedingte Einschränkung in der Funktion von ApoA-I vor, etwa durch die häufige C/C-Variante im APOA1-Gen, kann der Schutzmechanismus des HDL-Systems nicht vollständig greifen. In solchen Fällen sollte eine Omega-3-Supplementierung besonders gezielt geplant werden, da die Wirksamkeit unter strukturell ungünstigen Voraussetzungen eingeschränkt sein kann.
Je nach genetischer Ausgangslage, HDL-Subfraktionsprofil, Triglyzeridstatus und Entzündungsmarkern liegt die empfohlene Tagesdosis von EPA und DHA typischerweise im Bereich von 500 bis 1.000 mg, bei bestehender Dyslipidämie oder entzündlichen Prozessen können auch Dosierungen von 2.000 mg oder mehr therapeutisch sinnvoll sein. Für eine optimale Wirksamkeit empfiehlt sich eine parallele Versorgung mit antioxidativen Cofaktoren, insbesondere Vitamin E (Tocopherole und Tocotrienole), Coenzym Q10, Vitamin C sowie Selen, um einer potenziellen Lipidperoxidation ungesättigter Fettsäuren entgegenzuwirken und die zelluläre Membranintegrität zu schützen. Auch Phospholipidgebundene Omega-3-Formen, wie sie in Krillöl vorkommen, können bei eingeschränkter HDL-Funktion vorteilhaft sein.
Neben der gezielten Mikronährstoffversorgung spielt auch die Ernährung eine tragende Rolle. Besonders empfehlenswert sind fettreiche Kaltwasserfische wie Lachs, Hering, Makrele oder Sardinen, idealerweise aus Wildfang oder nachhaltiger Zucht. Auch Chiasamen, Leinsamen, Walnüsse und Algenöle liefern wertvolle Omega-3-Fettsäuren, wenngleich pflanzliche Formen wie ALA (Alpha-Linolensäure) nur begrenzt in EPA und DHA umgewandelt werden können. Gleichzeitig sollten proentzündliche Fette (z. B. Transfettsäuren, übermäßige Mengen Omega-6), stark verarbeitete Produkte, Rauchen und übermäßiger Alkoholkonsum möglichst reduziert werden, da sie das proentzündliche Milieu fördern und den Nutzen von Omega-3-Fettsäuren konterkarieren können.
Zusammenfassend lässt sich sagen: Die Kombination aus genetischer Diagnostik des APOA1-Gens, gezielter Supplementierung bioaktiver Omega-3-Fettsäuren, antioxidativer Unterstützung, fettbewusster Ernährung und einem ganzheitlich gesundheitsfördernden Lebensstil stellt einen wirkungsvollen und wissenschaftlich fundierten Ansatz zur Prävention und Therapie von HDL-Dysfunktion, Entzündungsbelastung und kardiovaskulären Risiken dar. Besonders bei eingeschränkter ApoA-I-Funktion kann dieses integrative Vorgehen entscheidend dazu beitragen, die Funktion des HDL-Systems zu stabilisieren, die antiinflammatorische Wirkung von Omega-3 zu entfalten und die langfristige Gesundheit gezielt zu fördern.
APOA1 gene: MedlinePlus Genetics. (o. D.). https://medlineplus.gov/genetics/gene/apoa1/#references
Benkhoff, M., & Polzin, A. (2024). Lipoprotection in cardiovascular diseases. Pharmacology & therapeutics, 264, 108747. https://doi.org/10.1016/j.pharmthera.2024.108747
Borja, M. S., Hammerson, B., Tang, C., Juarez-Serrano, L., Savinova, O. V., Harris, W. S., Oda, M. N. & Shearer, G. C. (2024). Effects of niacin and omega-3 fatty acids on HDL-apolipoprotein A-I exchange in subjects with metabolic syndrome. PLoS ONE, 19(2), e0296052. https://doi.org/10.1371/journal.pone.0296052
Cartolano, F. C., Dias, G. D., Miyamoto, S., & Damasceno, N. R. T. (2022). Omega-3 Fatty Acids Improve Functionality of High-Density Lipoprotein in Individuals With High Cardiovascular Risk: A Randomized, Parallel, Controlled and Double-Blind Clinical Trial. Frontiers in nutrition, 8, 767535. https://doi.org/10.3389/fnut.2021.767535
de Luis, D., Izaola, O., Primo, D., & Aller, R. (2019). Role of rs670 variant of APOA1 gene on metabolic response after a high fat vs. a low fat hypocaloric diets in obese human subjects. Journal of diabetes and its complications, 33(3), 249–254. https://doi.org/10.1016/j.jdiacomp.2018.10.015
de Luis, D. A., Izaola, O., Primo, D., & Aller, R. (2018). Role of rs670 variant of APOA1 gene on lipid profile, insulin resistance and adipokine levels in obese subjects after weight loss with a dietary intervention. Diabetes research and clinical practice, 142, 139–145. https://doi.org/10.1016/j.diabres.2018.05.040
de Luis Román, D. A., Izaola Jáuregui, O., Primo, D., & Aller, R. (2019). Influencia de la variante rs670 del gen APOA1 en la respuesta HDL sérica a una dieta hipocalórica enriquecida con grasas poliinsaturadas frente a una enriquecida con grasas monoinsaturadas [Influence of rs670 variant of APOA1 gene on serum HDL response to an enriched-polyunsaturated vs. an enriched-monounsaturated fat hypocaloric diet]. Nutricion hospitalaria, 36(6), 1288–1295. https://doi.org/10.20960/nh.02390
Georgila, K., Vyrla, D., & Drakos, E. (2019). Apolipoprotein A-I (ApoA-I), Immunity, Inflammation and Cancer. Cancers, 11(8), 1097. https://doi.org/10.3390/cancers11081097
Izaola, O., Primo, D., Gomez Hoyos, E., Lopez Gomez, J. J., Ortola, A., & de Luis, D. (2020). Association of rs670 variant of APOA1 gene with lipid profile and insulin resistance after 9 months of a high protein/low carbohydrate vs a standard hypocaloric diet. Clinical nutrition (Edinburgh, Scotland), 39(4), 988–993. https://doi.org/10.1016/j.clnu.2019.04.030
Laufs, U., Parhofer, K. G., Ginsberg, H. N., & Hegele, R. A. (2020). Clinical review on triglycerides. European heart journal, 41(1), 99–109c. https://doi.org/10.1093/eurheartj/ehz785
Mac Dionys Rodrigues da Costa, Bruna Ribeiro Duque, Natasha Maria Lima Pinheiro, Izabell Maria Martins Teixeira, Emanuel Paula Magalhães, Felipe Ramon Cunha da Silva, Mateus Edson da Silva, Alice Maria Costa Martins, Ramon Róseo Paula Pessoa Bezerra de Menezes, Tiago Lima Sampaio. Single-nucleotide polymorphism rs670 in the promoter region of the apolipoprotein A-I gene. Gene & Protein in Disease 2025, 4(1), 4354. https://doi.org/10.36922/gpd.4354
Peña-de-la-Sancha, P., Muñoz-García, A., Espínola-Zavaleta, N., Bautista-Pérez, R., Mejía, A. M., Luna-Luna, M., López-Olmos, V., Rodríguez-Pérez, J.-M., Fragoso, J.-M., Carreón-Torres, E., & Pérez-Méndez, Ó. (2023). Eicosapentaenoic and Docosahexaenoic Acid Supplementation Increases HDL Content in n-3 Fatty Acids and Improves Endothelial Function in Hypertriglyceridemic Patients. International Journal of Molecular Sciences, 24(6), 5390. https://doi.org/10.3390/ijms24065390
Ramezani-Jolfaie, N., Aghaei, S., Yazd, E. F., Moradi, A., Mozaffari-Khosravi, H., Zimorovat, A., Raeisi-Dehkordi, H., Moghtaderi, F., Amiri, M., Yasini Ardakani, S. A., & Salehi-Abargouei, A. (2020). Association of rs670 variant of APOA-1 gene with cardiometabolic markers after consuming sesame, canola and sesame-canola oils in adults with and without type 2 diabetes mellitus. Clinical nutrition ESPEN, 38, 129–137. https://doi.org/10.1016/j.clnesp.2020.05.016
Riggs, K. A., & Rohatgi, A. (2019). HDL and Reverse Cholesterol Transport Biomarkers. Methodist DeBakey cardiovascular journal, 15(1), 39–46. https://doi.org/10.14797/mdcj-15-1-39
rs670 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs670
Ściskalska, M., & Milnerowicz, H. (2022). Importance of Polymorphisms in the Gene of Paraoxonase-1 (SNP rs662) and Apolipoprotein A-I (SNP rs670 and rs5069) in Non-Smoking and Smoking Healthy Subjects and Patients with Acute Pancreatitis. Genes, 13(11), 1968. https://doi.org/10.3390/genes13111968