Lesedauer: 32 Minuten

Lesedauer: 32 Minuten

Reaktive Sauerstoffspezies (ROS) entstehen fortlaufend als Nebenprodukte der Zellatmung, insbesondere in den Mitochondrien. Werden sie nicht ausreichend neutralisiert, können sie DNA, Proteine und Lipide schädigen – ein Prozess, der zur Entwicklung zahlreicher chronischer Erkrankungen beiträgt. Der Körper verfügt über ein mehrstufiges antioxidatives Abwehrsystem, zu dem Enzyme wie SOD2, GPX1, GSTM1 und GSTT1 gehören. Ihre Funktion ist entscheidend für die zelluläre Redox-Homöostase, insbesondere unter Belastung durch Umweltfaktoren oder Entzündungsprozesse. Genetische Varianten oder Deletionen in diesen Genen können die Wirksamkeit des Schutzsystems erheblich beeinträchtigen – mit klinisch relevanten Folgen. Der folgende Beitrag erläutert die molekularen Mechanismen dieser Enzyme, beschreibt funktionelle Genvarianten und zeigt praxisnahe Strategien für eine personalisierte Prävention bei erhöhtem oxidativem Stress.
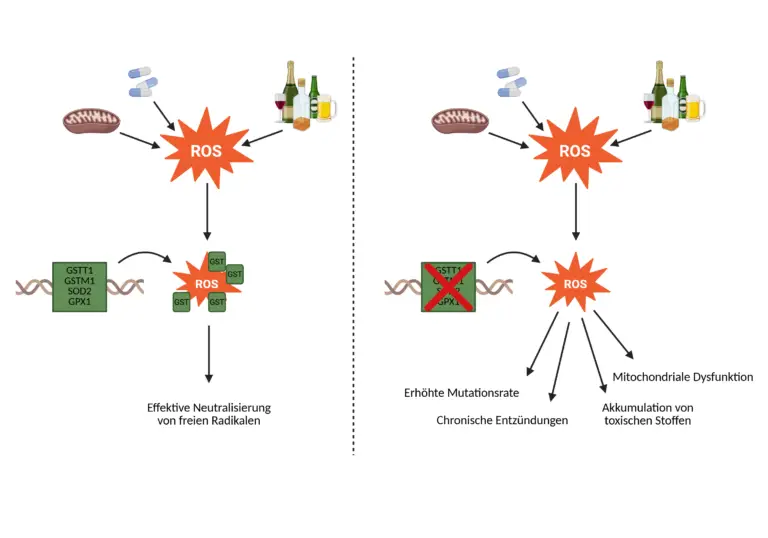
Freie Radikale, insbesondere reaktive Sauerstoffspezies (ROS), entstehen kontinuierlich im Körper und können durch externe Belastungen (UV-Strahlung, Umweltgifte, Entzündungen) stark zunehmen. Sie können DNA, Proteine und Zellmembranen schädigen und chronische Erkrankungen fördern.
Der Körper schützt sich über ein mehrstufiges antioxidatives System. Enzyme wie SOD2 (Superoxid-Dismutase) und GPX1 (Glutathionperoxidase) entschärfen ROS direkt in den Mitochondrien. GSTM1 und GSTT1 unterstützen die Entgiftung durch Bindung toxischer Abbauprodukte an Glutathion. Genetische Varianten oder Deletionen dieser Enzyme führen zu eingeschränkter Schutzfunktion, erhöhter oxidativer Belastung und gesteigertem Risiko für Zellschäden.
Für die medizinische Praxis ist wichtig, dass die Kenntnis der genetischen Varianten (z. B. SOD2 rs4880, GPX1 rs1050450, GSTM1-/GSTT1-Nullvarianten) eine personalisierte Prävention ermöglicht. Betroffene profitieren von gezielten antioxidativen Maßnahmen, etwa der Supplementierung von Selen, Glutathion, Coenzym Q10, Vitamin C/E oder Sulforaphan – sowie von der Reduktion exogener Belastungen. So kann sich das Risiko für oxidative Zellschäden und chronisch-entzündliche Erkrankungen deutlich reduzieren lassen.
Freie Radikale – allen voran reaktive Sauerstoffspezies (ROS) – entstehen kontinuierlich im menschlichen Organismus, insbesondere als Nebenprodukte der mitochondrialen Atmungskette. Zusätzliche Belastungen durch äußere Einflüsse wie UV-Strahlung, Luftschadstoffe, Tabakrauch, Alkohol, Medikamente oder chronische Entzündungen führen zu einer erhöhten ROS-Produktion. Diese Moleküle sind aufgrund ihres ungepaarten Elektrons hochreaktiv und versuchen, sich durch Elektronenentzug von benachbarten Molekülen zu stabilisieren. Das betrifft vor allem Lipide in Zellmembranen, Proteine und DNA – Strukturen, deren Schädigung zu funktionellen Störungen, Mutationen und letztlich zur Entstehung chronischer Erkrankungen führen kann. Wenn die körpereigenen Schutzsysteme nicht mehr ausreichen, um die ROS zu neutralisieren, spricht man von oxidativem Stress – einem zentralen Mechanismus bei der Entstehung von Erkrankungen wie Krebs, Arteriosklerose, Diabetes oder neurodegenerativen Erkrankungen.
Der menschliche Körper verfügt jedoch über ein antioxidatives Schutzsystem, das aus mehreren Ebenen besteht. Die erste Verteidigungslinie bilden enzymatische Antioxidantien, die freie Radikale direkt abbauen. Eine Schlüsselrolle spielt dabei das Enzym Superoxid Dismutase 2 (SOD2), das sich in den Mitochondrien befindet. SOD2 wandelt das besonders aggressive Superoxid-Anion (O₂•⁻) in Wasserstoffperoxid (H₂O₂) um – eine Reaktion, die zwar ein weniger reaktives, aber immer noch potenziell schädliches Molekül erzeugt. An dieser Stelle greift ein weiteres Enzym ein: Glutathion-Peroxidase 1 (GPX1), das mithilfe von reduziertem Glutathion (GSH) das Wasserstoffperoxid sowie organische Hydroperoxide in Wasser bzw. harmlose Alkoholverbindungen umwandelt. SOD2 und GPX1 bilden zusammen ein zentrales Abwehrpaar gegen mitochondriale ROS und verhindern so Schäden an mitochondrialer DNA– ein kritischer Schutzmechanismus angesichts der zentralen Rolle der Mitochondrien in der zellulären Energieversorgung und im Alterungsprozess.
Während SOD2 und GPX1 primär reaktive Sauerstoffspezies selbst abbauen, sind Enzyme der Glutathion-S-Transferase-Familie (GST) – insbesondere GSTM1 und GSTT1 – in einer nachgelagerten Entgiftungsphase (Phase II Entgiftung) aktiv. Sie binden Glutathion an bereits oxidierte und reaktive Metabolite und machen diese dadurch wasserlöslich, sodass sie über Leber und Niere ausgeschieden werden können.
Bei genetisch bedingtem Funktionsverlust dieser Entgiftungsenzyme – etwa durch eine homozygote Deletion des GSTM1- oder GSTT1-Gens (sogenannte Null-Allele) fehlt dieser Schutzmechanismus vollständig. In solchen Fällen kommt es zu einer stärkeren Akkumulation von toxischen Zwischenprodukten, einem erhöhten oxidativen Stresslevel und potenziell einer verstärkten mitochondrialen Dysfunktion. Auch bestimmte Polymorphismen in SOD2 (z. B. der rs4880) oder GPX1 (z. B. rs1050450) können die Aktivität dieser Enzyme beeinträchtigen und die antioxidative Schutzwirkung weiter verringern.
Zusammenfassend lässt sich sagen: Die Enzyme SOD2, GPX1, GSTM1 und GSTT1 bilden ein eng koordiniertes Netzwerk zum Schutz vor oxidativem Stress. SOD2 entschärft die erste Angriffswelle durch Superoxidradikale, GPX1 reduziert das entstehende Wasserstoffperoxid, und die GST-Enzyme übernehmen die gezielte Bindung und Ausscheidung der daraus entstehenden toxischen Metaboliten. Störungen in einem dieser Systeme – sei es durch genetische Varianten oder Umweltbelastungen – können das Gleichgewicht stören. Die Kenntnis der individuellen genetischen Ausstattung dieser Enzyme ist daher ein zentraler Schlüssel in der personalisierten Präventivmedizin und Grundlage für gezielte, vorbeugende Maßnahmen im Bereich Mikronährstoffversorgung und Lebensstilgestaltung.
Das Glutathion-S-Transferase Theta 1-Gen (GSTT1) befindet sich auf Chromosom 22 an der Position q11.23 (langer Arm des Chromosoms) und kodiert für das gleichnamige Enzym, das eine maßgebende Rolle in der zellulären Entgiftung und im Schutz vor oxidativem Stress, insbesondere durch die Neutralisierung freier Radikale, spielt.
Das GSTT1-Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs), die an der Phase-II-Entgiftung beteiligt sind. Dabei katalysiert GSTT1 die Konjugation von Glutathion (GSH, ein wichtiges Antioxidans) mit toxischen Substanzen, um sie wasserlöslicher und damit ausscheidbar zu machen. Wenn freie Radikale mit Membranlipiden oder anderen Molekülen im Körper reagieren, entstehen elektrophile Verbindungen, das heißt, dass diese Moleküle ein Elektron zu wenig besitzen und dadurch sehr reaktiv sind. Diese reaktiven Moleküle stellen eine große Gefahr für Zellstrukturen dar, da sie spontane Bindungen mit DNA, Proteinen oder Lipiden eingehen und dadurch irreversible Schäden verursachen können. An dieser Stelle kommt GSTT1 ins Spiel: Das Enzym erkennt die elektrophile Gruppe des Schadstoffes und hilft die Thiolgruppe (-SH) von reduziertem Glutathion (GSH) auf das elektrophile Zentrum des Zielmoleküls zu übertragen. Die Folge ist eine kovalente Bindung zwischen Glutathion und dem Schadstoff – das sogenannte Glutathion-Konjugat (R-SG) entsteht. Der entstehende Konjugatkomplex ist in der Regel wasserlöslich, chemisch stabil und kann in der Folge entweder direkt renal ausgeschieden oder in der Leber durch nachgeschaltete Reaktionen weiterverarbeitet und eliminiert werden. Der gesamte Prozess dient somit dazu, lipophile und reaktive Moleküle in hydrophilere, biologisch inaktive Formen zu überführen, die keine zellulären Schäden mehr verursachen können. GSTT1 wirkt dabei wie ein molekularer „Filter“, der gefährliche Zwischenprodukte der oxidativen Belastung erkennt und durch die Kopplung mit Glutathion für den Abtransport vorbereitet. Diese Funktion ist besonders wichtig, wenn freie Radikale durch externe Einflüsse wie Umweltgifte, Medikamente, UV-Strahlung oder chronische Entzündungen vermehrt auftreten und der Körper verstärkt auf seine endogene Entgiftungskapazität angewiesen ist.
Fällt GSTT1 aufgrund einer homozygoten Deletion (GSTT1-Null-Genotyp) aus, kann dieser Entgiftungsweg nicht mehr stattfinden. Die betroffenen reaktiven Substanzen bleiben länger im Körper, erhöhen die oxidative Last und begünstigen dadurch langfristig Zellschädigungen, chronische Entzündungen oder karzinogene Prozesse. Aus diesem Grund ist GSTT1 ein wichtiges Element in der Phase-II-Entgiftung und eng mit dem körpereigenen antioxidativen Schutzsystem verknüpft.
Eine der wichtigsten Genvarianten im Zusammenhang mit GSTT1 (Glutathion-S-Transferase Theta 1) ist das sogenannte Nullallel, das durch eine homozygote Deletion des gesamten GSTT1-Gens entsteht. Im Gegensatz zu typischen Polymorphismen, bei denen einzelne Basenpaare verändert sind (SNPs), handelt es sich beim GSTT1-Nullallel um eine strukturelle Variante, bei der das Gen vollständig fehlt. Die GSTT1-Deletion entsteht durch eine fehlerhafte homologe Rekombination während der Meiose, insbesondere in der genetisch instabilen Region q11.23 auf Chromosom 22. Diese Region ist von sogenannten segmentalen Duplikationen umgeben, das sind DNA-Abschnitte mit nahezu identischen DNA-Sequenzen, die anfällig für Fehlpaarungen und daraus resultierende Deletionen sind. Solche Reorganisationsereignisse können dazu führen, dass das GSTT1-Gen verloren geht.
Das Glutathion-S-Transferase Mu 1-Gen (GSTM1) befindet sich auf Chromosom 1 an der Position p13.3 (kurzer Arm des Chromosoms). Es kodiert für das gleichnamige Enzym, das eine zentrale Aufgabe im körpereigenen Schutzsystem gegen toxische Verbindungen übernimmt. GSTM1 spielt eine Schlüsselrolle im Rahmen der Phase-II-Entgiftung, also der biochemischen Umwandlung potenziell schädlicher Substanzen in eine Form, die für den Organismus unschädlich und ausscheidbar ist.
Das von GSTM1 gebildete Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs) und ist insbesondere dafür zuständig, reaktive, elektrophile Moleküle, die z. B. durch oxidativen Stress, Entzündungen, Umweltgifte oder Arzneimittel entstehen, mit reduziertem Glutathion (GSH) zu verknüpfen. Reaktiven Substanzen entstehen häufig als Nebenprodukte von Stoffwechselprozessen, vor allem dann entstehen, wenn freie Radikale Zellmembranen oder andere empfindliche Moleküle angreifen. Im Zentrum der Funktion von GSTM1 steht die katalytische Übertragung des Glutathions auf das jeweilige Schadstoffmolekül. Das Enzym erkennt die gefährlichen Stoffe anhand ihrer chemischen Struktur und richtet sie so aus, dass die Schwefelgruppe des Glutathions mit dem reaktiven Zentrum der Substanz eine stabile kovalente Bindung eingehen kann. Das so gebildete Glutathion-Konjugat ist im Gegensatz zur ursprünglichen Substanz inaktiv, meist hydrophil und kann über die Niere oder die Leber ausgeschieden werden. Auf diese Weise verhindert GSTM1, dass reaktive Substanzen länger im Körper verbleiben und dort biologische Strukturen wie Proteine, Lipide oder DNA schädigen. Die Funktion von GSTM1 ist somit besonders in Situationen mit hoher Belastung durch oxidative oder toxische Reize entscheidend. Durch seine Aktivität trägt es dazu bei, das zelluläre Gleichgewicht aufrechtzuerhalten, Schäden zu begrenzen und den Körper gegen die schleichenden Folgen von Umweltbelastungen oder entzündlichen Prozessen zu schützen.
Kommt es jedoch zu einer kompletten Deletion des GSTM1-Gens – also dem sogenannten GSTM1-Null-Genotyp –, fällt dieser Schutzmechanismus weg. Das bedeutet, dass bestimmte Schadstoffe nicht mehr effektiv gebunden und ausgeleitet werden können. Sie verbleiben länger im Organismus, können sich in Geweben ansammeln und zu erhöhtem oxidativem Stress, einer steigenden Mutationsrate sowie zu einem erhöhten Risiko für Erkrankungen wie Krebs, chronische Entzündungen oder degenerative Prozesse beitragen.
Eine besonders relevante genetische Variante im Zusammenhang mit dem GSTM1-Gen (Glutathion-S-Transferase Mu 1) ist das sogenannte Nullallel, das durch das vollständige Fehlen beider Genkopien – also eine homozygote Deletion – entsteht. Im Gegensatz zu Einzelbasenveränderungen, handelt es sich beim GSTM1-Nullallel um eine strukturelle Genveränderung, bei der der gesamte Genabschnitt dauerhaft aus dem Genom entfernt wurde. Die Ursache für diese Deletion liegt in einem mechanischen Fehler während der meiotischen Zellteilung. Die betroffene Region befindet sich auf dem kurzen Arm von Chromosom 1, genauer gesagt im Bereich 1p13.3, einer Zone, die für genetische Instabilität bekannt ist. Diese Instabilität ist unter anderem auf das Vorkommen sogenannter segmentaler Duplikationen zurückzuführen – das sind DNA-Abschnitte mit hoher Sequenzähnlichkeit, die zu einer fehlerhaften Ausrichtung der Chromosomenpaare während der Meiose führen können. In Folge dieser Fehlanordnung kann es zu einem Rekombinationsfehler kommen, bei dem das GSTM1-Gen vollständig ausgeschnitten und nicht in die Keimbahn weitergegeben wird. Das Ergebnis ist eine genetische Konstellation, bei der kein funktionsfähiges GSTM1-Enzym mehr gebildet werden kann, da dem Erbgut beide Kopien dieses Gens fehlen. In funktioneller Hinsicht bedeutet das, dass der Körper auf einen wichtigen Entgiftungsmechanismus verzichten muss – nämlich auf die Fähigkeit, bestimmte reaktive Metaboliten über die Konjugation mit reduziertem Glutathion (GSH) zu binden und damit unschädlich zu machen. Diese Variante kann Auswirkungen auf die individuelle Entgiftungskapazität haben, insbesondere bei der Verarbeitung von Substanzen wie Karzinogenen, Umweltgiften oder bestimmten Medikamentenmetaboliten.
Bei 56% der Bevölkerung ist das GSTM1-Gen intakt, sodass das entsprechende Enzym in ausreichender Menge gebildet werden kann. In diesen Fällen funktioniert der zelluläre Schutzmechanismus gegen reaktive Schadstoffe und oxidative Abbauprodukte effektiv. Bei den übrigen rund 44% der Menschen liegt jedoch eine homozygote Deletion des GSTM1-Gens vor, was bedeutet, dass beide Kopien dieses Gens fehlen und somit kein funktionelles Enzym produziert werden kann. Die Folge ist ein deutlich eingeschränktes Entgiftungspotenzial, insbesondere für bestimmte toxische Verbindungen wie Umweltkarzinogene, reaktive Aldehyde und Arzneimittelmetaboliten. Fehlt das Enzym dauerhaft, kann der Körper solche Substanzen nicht mehr ausreichend abbauen. Sie verbleiben länger im Gewebe, wo sie mit körpereigenen Molekülen reagieren können. Dabei entstehen kovalente Bindungen zu DNA, Proteinen und Zellmembranen, was zu dauerhaften Schäden an wichtigen Zellstrukturen führt. Vor allem Gewebe mit hoher Stoffwechselaktivität oder Zellteilungsrate, wie etwa die Leber, die Atemwege oder das Knochenmark, sind von diesen Vorgängen betroffen. Auf längere Sicht kann dieser Enzymmangel zu einer verstärkten Anhäufung oxidativer Zwischenprodukte, einer zunehmenden chronischen Entzündungsneigung und einer höheren Rate genetischer Veränderungen führen. Diese Bedingungen gelten als zentrale Mechanismen bei der Entstehung verschiedenster chronischer Erkrankungen – von Tumorerkrankungen über kardiometabolische Störungen bis hin zu neurodegenerativen Prozessen. Das Fehlen von GSTM1 stellt daher einen relevanten Risikofaktor im Kontext oxidativen und toxischen Zellstresses dar und verdient besondere Aufmerksamkeit in der individualisierten Prävention.
Das Superoxid-Dismutase 2-Gen (SOD2) liegt auf dem langen Arm von Chromosom 6 an der Position q25.3 und kodiert für das mitochondriale Enzym Mangan-Superoxid Dismutase (MnSOD). Dieses Enzym ist von zentraler Bedeutung für den zellulären Schutz vor oxidativem Stress, da es direkt an der Entschärfung freier Radikale beteiligt ist; insbesondere in der energieintensiven Umgebung der Mitochondrien, wo Sauerstoffradikale in hoher Konzentration entstehen.
MnSOD gehört zur Familie der Superoxiddismutasen (SODs) und übernimmt eine essenzielle Rolle im Rahmen der primären antioxidativen Abwehr. Es katalysiert die Reaktion des aggressiven Superoxid-Anions (O₂•⁻), einem Nebenprodukt der mitochondrialen Atmungskette, zu Wasserstoffperoxid (H₂O₂) und molekularem Sauerstoff (O₂). Während Superoxid hochreaktiv und stark zellschädigend ist, kann Wasserstoffperoxid in einem nächsten Schritt durch Enzyme wie Glutathion-Peroxidase (GPX1) oder Katalase weiter zu Wasser abgebaut werden. Die Aktivität von MnSOD ist dabei besonders wichtig, da Superoxid bereits in geringsten Mengen DNA, Proteine oder Lipide oxidieren und damit weitreichende zelluläre Schäden verursachen kann.
Im aktiven Zentrum hat das Enzym ein Mangan-Ion (Mn²⁺), das den Elektronentransfer zwischen zwei Superoxid-Molekülen vermittelt. Der Ablauf dieser enzymatischen Reaktion schützt die Zelle nicht nur vor akuten Schäden, sondern verhindert auch die Entstehung weiterer reaktiver Folgeprodukte, wie z. B. Peroxynitrit, das bei einer Reaktion von Superoxid mit Stickstoffmonoxid entstehen würde. MnSOD wirkt in der mitochondrialen Matrix und katalysiert dort die sogenannte Dismutation von zwei Molekülen Superoxid-Anion (O₂•⁻). Dabei läuft die Reaktion in zwei aufeinanderfolgenden Schritten ab: Im ersten Schritt wird ein Superoxid-Molekül reduziert, während das im aktiven Zentrum befindliche Mangan-Ion von der Oxidationsstufe Mn³⁺ zu Mn²⁺ übergeht. Dabei entsteht molekularer Sauerstoff (O₂). Im zweiten Schritt reagiert ein weiteres Superoxid-Anion gemeinsam mit zwei Protonen (H⁺) mit dem nun reduzierten Mangan-Ion (Mn²⁺). Das Mangan wird dabei wieder zu Mn³⁺ oxidiert, und es entsteht Wasserstoffperoxid (H₂O₂). Zusammengefasst wandelt das Enzym also zwei Moleküle Superoxid und zwei Protonen in ein Molekül Wasserstoffperoxid und ein Molekül molekularen Sauerstoff um. Das Mangan-Ion dient dabei als Elektronentransferzentrum und wechselt während der Reaktion zyklisch zwischen zwei Oxidationsstufen hin und her. Diese Reaktion ist von zentraler Bedeutung für den antioxidativen Schutz der Mitochondrien, da Superoxid zu den aggressivsten reaktiven Sauerstoffspezies zählt.
Fällt das SOD2-Gen aufgrund einer genetischen Variante mit funktioneller Relevanz in seiner Aktivität stark reduziert aus, ist die mitochondriale Fähigkeit zur Neutralisierung von Superoxid-Radikalen erheblich eingeschränkt. Infolgedessen reichern sich diese aggressiven Sauerstoffmoleküle in der mitochondrialen Matrix an, wo sie oxidativen Schaden anrichten können, insbesondere an mitochondrialer DNA, Membranlipiden und Atmungsenzymen. Die Folge ist eine erhöhte oxidative Belastung, die auf zellulärer Ebene zur Schädigung zentraler Zellstrukturen, zur Aktivierung entzündlicher Signalwege und zur Förderung von Mutationen führen kann. Über längere Zeit hinweg begünstigt dies die Entstehung chronisch-entzündlicher und degenerativer Erkrankungen sowie maligner Zellveränderungen.
Eine der klinisch besonders relevanten Genvarianten im Zusammenhang mit dem SOD2-Gen (Superoxid-Dismutase 2) ist der rs4880-Polymorphismus, bei dem es zu einem Austausch der Aminosäure Alanin gegen Valin an Position 16 des Proteins kommt, durch den Basenaustausch von Guanin zu Adenosin. Anders als bei strukturellen Varianten wie Gen-Deletionen, bei denen ganze Genabschnitte fehlen, handelt es sich hierbei um eine Punktmutation (Single Nucleotide Polymorphism, SNP), die die Funktion des Enzyms nicht direkt, sondern auf indirekte Weise beeinflusst. Die Besonderheit dieses SNPs liegt darin, dass er nicht das katalytische Zentrum des Enzyms verändert, sondern das sogenannte mitochondriale Targeting-Signal (MTS), einen Abschnitt des Proteins, der für den korrekten Import des Enzyms in die mitochondriale Matrix verantwortlich ist. Je nachdem, welche Aminosäure an Position 16 vorliegt, Valin (A/A) oder Alanin (G/G), verändert sich die dreidimensionale Struktur dieses Signalbereichs. Die G/G-Variante führt zu einer flexibleren Struktur, die effizient vom mitochondrialen Importapparat erkannt wird. Die A/A-Variante hingegen erzeugt eine steifere Helixstruktur, die den Import deutlich erschwert. Diese Veränderung kann zur Folge haben, dass bei homozygoten Trägern des A/A-Genotyps nur unzureichende Mengen aktiver Mangan-Superoxiddismutase (MnSOD) in die Mitochondrien gelangen. Dort aber entsteht während der zellulären Atmung ein Großteil der freien Sauerstoffradikale – insbesondere das hochreaktive Superoxid-Anion (O₂•⁻). Ist die MnSOD-Aktivität reduziert, wird dieses Radikal nicht effizient zu Wasserstoffperoxid und Sauerstoff umgewandelt, was zu einer erhöhten ROS-Belastung in der Mitochondrienmatrix führt.
Bei etwa 20 % der Bevölkerung liegt der G/G-Genotyp des SOD2-Gens vor. In diesem Fall kann das Enzym Mangan-Superoxiddismutase (MnSOD) in der Regel effizient in die Mitochondrien eingeschleust und dort in ausreichender Menge aktiv sein. Die zelluläre Schutzfunktion gegen freie Sauerstoffradikale, insbesondere gegen das hochreaktive Superoxid-Anion (O₂•⁻), ist weitgehend gewährleistet. Diese Variante stellt die funktionell günstigste Ausprägung dar, da die mitochondriale Importmaschinerie das Enzym optimal erkennt und verarbeitet. Etwa 43 % der Menschen sind heterozygot (A/G oder G/A). Hier ist die Transporteffizienz von MnSOD in die mitochondriale Matrix leicht reduziert, was je nach individueller Belastungssituation (z. B. durch Umweltfaktoren, chronische Entzündungen oder hohe Stoffwechselaktivität) zu einer moderat eingeschränkten antioxidativen Abwehr führen kann. Die Schutzfunktion ist zwar grundsätzlich vorhanden, jedoch nicht unter allen Bedingungen voll belastbar. Bei den verbleibenden 37% der Bevölkerung, die den A/A-Genotyp tragen, ist der Import des Enzyms in die Mitochondrien deutlich erschwert. Die Folge ist eine verminderte Verfügbarkeit aktiver MnSOD-Enzyme am Ort der höchsten ROS-Produktion. Auf zellulärer Ebene bedeutet das eine erhöhte Anreicherung von Superoxid-Radikalen, die nicht effektiv entschärft werden können. Diese Radikale reagieren sehr schnell mit DNA, Proteinen oder Lipiden und führen dort zu oxidativen Schäden, die die Funktion und Struktur der betroffenen Zellbestandteile nachhaltig beeinträchtigen. Besonders anfällig sind Gewebe mit hoher Stoffwechselaktivität, wie z. B. das Herz, Gehirn, die Muskulatur und die Leber, sowie Zellen mit hoher Mitochondriendichte.
Das Glutathionperoxidase 1-Gen (GPX1) befindet sich auf Chromosom 3 an der Position p21.3 (kurzer Arm des Chromosoms) und kodiert für das Enzym Glutathionperoxidase 1 (GPX1), das eine zentrale Rolle im antioxidativen Schutzsystem des Körpers spielt. Insbesondere schützt GPX1 die Zelle vor oxidativem Stress, indem es reaktive Sauerstoffspezies, insbesondere Wasserstoffperoxid (H₂O₂) und organische Hydroperoxide, neutralisiert, bevor diese Zellstrukturen schädigen können.
GPX1 gehört zur Familie der selenabhängigen Glutathionperoxidasen, die essenzielle Bestandteile der zellulären Redox-Homöostase sind. Das Enzym katalysiert die Reduktion von Wasserstoffperoxid zu Wasser, indem es reduziertes Glutathion (GSH) als Elektronendonor verwendet. Dabei werden zwei Moleküle GSH zu Glutathiondisulfid (GSSG) oxidiert, während H₂O₂ in harmlose Bestandteile aufgespalten wird. Dieser Mechanismus schützt vor allem zelluläre Membranen, DNA und Enzyme vor der schädigenden Wirkung von Peroxiden und trägt entscheidend zur Erhaltung der Zellintegrität bei. Wenn im Organismus durch äußere Einflüsse wie UV-Strahlung, Umweltgifte, Alkohol, chronische Entzündungen oder intensive Stoffwechselaktivität vermehrt freie Radikale entstehen, führt das häufig zur Bildung großer Mengen Wasserstoffperoxid. GPX1 verhindert in diesem Kontext, dass H₂O₂ durch weitere Reaktionen in noch reaktivere und gefährlichere Radikale wie das Hydroxylradikal (•OH) umgewandelt wird, eines der aggressivsten bekannten Zellgifte. Durch die kontinuierliche Umwandlung von H₂O₂ in Wasser wirkt GPX1 wie ein biochemischer Puffer gegen eskalierenden oxidativen Stress.
Die Effizienz dieses Schutzmechanismus wird maßgeblich durch den rs1050450-Polymorphismus im GPX1-Gen beeinflusst. Dieser SNP führt zu einem Austausch der Aminosäure Prolin gegen Leucin an Position 198 des Enzyms (Pro198Leu) durch die Basensubstitution von Guanin zu Adenin. Diese strukturelle Veränderung kann die räumliche Faltung des Proteins sowie dessen Stabilität und enzymatische Aktivität beeinträchtigen. Insbesondere bei homozygoten Trägern der Leu-Variante (A/A-Genotyp) wurde eine verminderte GPX1-Aktivität beobachtet, wodurch die Fähigkeit zur effektiven Reduktion von Wasserstoffperoxid eingeschränkt ist. In der Folge verbleibt H₂O₂ länger in der Zelle, was zu einer erhöhten Belastung durch oxidative Reaktionen führt. Diese können die Integrität von DNA, Lipiden und Proteinen beeinträchtigen und langfristig die Entstehung von chronisch-entzündlichen und degenerativen Erkrankungen fördern. Besonders betroffen sind Zellen mit hoher oxidativer Aktivität wie Hepatozyten, Neuronen, Immunzellen oder Endothelzellen.
Bei etwa 62 % der Bevölkerung liegt der G/G-Genotyp des GPX1-Gens vor. In dieser genetischen Konstellation wird das Enzym Glutathionperoxidase 1 (GPX1) in seiner funktionell voll aktiven Form mit Prolin an Position 198 gebildet. Das bedeutet, dass die Fähigkeit der Zelle, Wasserstoffperoxid (H₂O₂) und organische Hydroperoxide mithilfe von reduziertem Glutathion (GSH) effektiv zu neutralisieren, weitgehend erhalten bleibt. Die zelluläre Schutzfunktion gegen Peroxid-belasteten oxidativen Stress ist bei diesem Genotyp optimal, was diesen als funktionell günstigste Variante einordnet. Vor allem in Geweben mit hoher oxidativer Aktivität wie Leber, Niere, Herz oder Endothel ist die volle Aktivität von GPX1 von großer Bedeutung, um die mitochondriale und zelluläre Integrität zu bewahren. Rund 33–35 % der Menschen tragen den heterozygoten A/G oder G/A-Genotyp, bei dem eine Kopie des Gens die Prolin-Variante, die andere die Leucin-Variante (Leu198) kodiert. Diese Veränderung kann die Struktur und Stabilität des Enzyms leicht beeinflussen, was sich in einer moderat reduzierten Enzymaktivität äußern kann. Die antioxidative Schutzfunktion von GPX1 ist grundsätzlich weiterhin vorhanden, kann jedoch bei erhöhter Belastung wie durch chronische Entzündungen, intensive körperliche Aktivität, Medikamentenexposition oder Umweltgifte nicht immer in vollem Umfang ausreichen, um Peroxid-vermittelte Schäden zuverlässig zu verhindern. Bei den verbleibenden 5 % der Bevölkerung, die den A/A-Genotyp (homozygot für Leu198) aufweisen, ist die Fähigkeit zur Entgiftung von Wasserstoffperoxid deutlich eingeschränkt. Studien zeigen, dass die Enzymaktivität bei dieser Variante messbar reduziert ist, was dazu führt, dass H₂O₂ langsamer abgebaut wird und in der Zelle länger verfügbar bleibt. Dies erhöht das Risiko, dass sich Wasserstoffperoxid über weitere Reaktionen in das extrem aggressive Hydroxylradikal (•OH) umwandelt. Letzteres kann innerhalb kürzester Zeit DNA-Stränge brechen, Proteine denaturieren und Lipidmembranen peroxidieren, wodurch es zu weitreichenden strukturellen und funktionellen Schäden kommt.
Langfristig kann dieser Ungleichgewichtszustand zu einer chronischen Erhöhung des oxidativen Stresses, einer gesteigerten Entzündungsanfälligkeit sowie einer Zunahme genetischer Instabilität und Mutationen führen. Diese Faktoren begünstigen die Entstehung verschiedenster Erkrankungen, darunter neurodegenerative Störungen, Herz-Kreislauf-Erkrankungen und auch Tumorerkrankungen. Aus präventivmedizinischer Sicht ist die genetische Kenntnis des SOD2 rs4880-Polymorphismus besonders bedeutsam, da sich daraus personalisierte Schutzstrategien ableiten lassen. Menschen mit dem A/A-Genotyp profitieren insbesondere von Maßnahmen zur Stärkung alternativer antioxidativer Systeme, wie der gezielten Zufuhr von Mangan (als Cofaktor von MnSOD), Coenzym Q10, Alpha-Liponsäure, Vitamin C und E, Sulforaphan, Glutathion oder N-Acetylcystein (NAC). Ebenso entscheidend sind die Reduktion exogener oxidativer Belastungen (z. B. durch Rauchverzicht, Umweltgifte, übermäßigen Alkoholkonsum) und eine individuell abgestimmte Anpassung von Ernährung, Lebensstil und Medikamenten. Durch diese gezielten präventiven Maßnahmen kann das durch den A/A-Genotyp erhöhte Risiko für mitochondriale Schädigung und deren Langzeitfolgen wirksam reduziert werden. Ein zentraler Schritt in Richtung einer vorausschauenden, genetisch informierten Gesundheitsvorsorge.
Menschen mit einer genetisch bedingten verminderten Aktivität des Enzyms Glutathionperoxidase 1 (GPX1), insbesondere bei Vorliegen des A/A-Genotyps des rs1050450-Polymorphismus (Leu198Leu), profitieren besonders von gezielten präventiven Maßnahmen, die die antioxidative Abwehr stärken, oxidativen Stress reduzieren und das Risiko langfristiger Zellschäden minimieren können. Ein zentraler Ansatz ist die Optimierung der Selenversorgung, da Selen als essentieller Cofaktor für die Aktivität von GPX1 unerlässlich ist. Nur bei ausreichender Selensättigung kann das Enzym seine Schutzfunktion zuverlässig ausüben. Eine tägliche Aufnahme von 100 bis 200 µg Selen, idealerweise in Form von Selenmethionin oder natürlicher Selenhefe, gilt als sinnvoll, insbesondere wenn Blutanalysen auf einen Mangel hinweisen. Gleichzeitig sollte der Glutathion-Stoffwechsel unterstützt werden, da GPX1 für seine enzymatische Funktion auf reduziertes Glutathion (GSH) angewiesen ist. Hierbei spielen Nährstoffe wie N-Acetylcystein (NAC), Glycin, Glutamin sowie Alpha-Liponsäure eine wichtige Rolle, da sie die körpereigene GSH-Synthese fördern oder regenerierend auf bereits oxidiertes Glutathion wirken. Bei erhöhtem Bedarf kann auch die direkte Gabe von Glutathion, etwa in liposomaler Form, hilfreich sein. Darüber hinaus ist es sinnvoll, den Organismus mit zusätzlichen Antioxidantien zu versorgen, die den durch die eingeschränkte GPX1-Aktivität entstehenden Mangel an Peroxidabbau kompensieren können. Besonders bewährt haben sich hier Vitamin C und Vitamin E, die in ihrer Wirkung synergistisch sind, sowie Coenzym Q10, das die Mitochondrien schützt und die Bildung freier Radikale reduziert. Auch sekundäre Pflanzenstoffe wie Resveratrol, Quercetin, OPC oder Astaxanthin können als Radikalfänger wirksam in das antioxidative Netzwerk integriert werden.
DocCheck Flexikon. (o. J.). Reaktive Sauerstoffspezies. Abgerufen am 17. Juni 2025 von https://flexikon.doccheck.com/de/Reaktive_Sauerstoffspezies
Fachverlag, T. G. M. (2019, 13. Juni). Reaktive Sauerstoffspezies (ROS) als Signalmoleküle und metabolische Regulatoren in T-Lymphozyten. https://www.trillium.de/zeitschriften/trillium-immunologie/archiv/ausgaben-2019/heft-22019/aus-der-klinischen-forschung/reaktive-sauerstoffspezies-ros-als-signalmolekuele-und-metabolische-regulatoren-in-t-lymphozyten.html#:~:text=Wie%20bereits%20angesprochen%20konvertieren%20SODs,Signalverarbeitung%20und%20im%20Metabolismus%20f%C3%BChren
Peoples, J.N., Saraf, A., Ghazal, N. et al. Mitochondrial dysfunction and oxidative stress in heart disease. Exp Mol Med 51, 1–13 (2019). https://doi.org/10.1038/s12276-019-0355-7
Cao, T., Xu, N., Wang, Z., & Liu, H. (2017). Effects of Glutathione S-Transferase Gene Polymorphisms and Antioxidant Capacity per Unit Albumin on the Pathogenesis of Chronic Obstructive Pulmonary Disease. Oxidative medicine and cellular longevity, 2017, 6232397. https://doi.org/10.1155/2017/6232397
Nakanishi, G., Pita-Oliveira, M., Bertagnolli, L. S., Torres-Loureiro, S., Scudeler, M. M., Cirino, H. S., Chaves, M. L., Miwa, B. & Rodrigues-Soares, F. (2022). Worldwide Systematic Review of GSTM1 and GSTT1 Null Genotypes by Continent, Ethnicity, and Therapeutic Area. OMICS A Journal Of Integrative Biology, 26(10), 528–541. https://doi.org/10.1089/omi.2022.0090
Sadafi, S., Choubsaz, P., Kazemeini, S.M.M. et al. Glutathione S-transferase theta 1 (GSTT1) deletion polymorphism and susceptibility to head and neck carcinoma: a systematic review with five analyses. BMC Cancer 24, 885 (2024). https://doi.org/10.1186/s12885-024-12618-7
Sireesha, R., Bhagya Laxmi, S. G., Mamata, M., Yadagiri Reddy, P., Upender Goud, P., Venkateshwar Rao, P., Bhanuprakash Reddy, G., Vishnupriya, S., & Padma, T. (2012). Total activity of glutathione-S-transferase (GST) and polymorphisms of GSTM1 and GSTT1 genes conferring risk for the development of age-related cataracts. Experimental Eye Research, 98, 67–74. https://doi.org/10.1016/j.exer.2012.03.002
Cao, T., Xu, N., Wang, Z., & Liu, H. (2017). Effects of Glutathione S-Transferase Gene Polymorphisms and Antioxidant Capacity per Unit Albumin on the Pathogenesis of Chronic Obstructive Pulmonary Disease. Oxidative medicine and cellular longevity, 2017, 6232397. https://doi.org/10.1155/2017/6232397
Le, T. H. (2021). GSTM1 Gene, Diet, and Kidney Disease: Implication for Precision Medicine?: Recent Advances in Hypertension. Hypertension, 78(4), 936–945. https://doi.org/10.1161/hypertensionaha.121.16510
Nakanishi, G., Pita-Oliveira, M., Bertagnolli, L. S., Torres-Loureiro, S., Scudeler, M. M., Cirino, H. S., Chaves, M. L., Miwa, B. & Rodrigues-Soares, F. (2022). Worldwide Systematic Review of GSTM1 and GSTT1 Null Genotypes by Continent, Ethnicity, and Therapeutic Area. OMICS A Journal Of Integrative Biology, 26(10), 528–541. https://doi.org/10.1089/omi.2022.0090
Sireesha, R., Bhagya Laxmi, S. G., Mamata, M., Yadagiri Reddy, P., Upender Goud, P., Venkateshwar Rao, P., Bhanuprakash Reddy, G., Vishnupriya, S., & Padma, T. (2012). Total activity of glutathione-S-transferase (GST) and polymorphisms of GSTM1 and GSTT1 genes conferring risk for the development of age-related cataracts. Experimental Eye Research, 98, 67–74. https://doi.org/10.1016/j.exer.2012.03.002
Chidambaram, S. B., Anand, N., Varma, S. R., Ramamurthy, S., Vichitra, C., Sharma, A., Mahalakshmi, A. M., & Essa, M. M. (2024). Superoxide dismutase and neurological disorders. IBRO Neuroscience Reports, 16, 373–394. https://doi.org/10.1016/j.ibneur.2023.11.007
Ekoue, D. N., He, C., Diamond, A. M., & Bonini, M. G. (2017). Manganese superoxide dismutase and glutathione peroxidase-1 contribute to the rise and fall of mitochondrial reactive oxygen species which drive oncogenesis. Biochimica et biophysica acta. Bioenergetics, 1858(8), 628–632. https://doi.org/10.1016/j.bbabio.2017.01.006
Gallegos-Arreola, M. P., Ramírez-Patiño, R., Sánchez-López, J. Y., Zúñiga-González, G. M., Figuera, L. E., Delgado-Saucedo, J. I., Gómez-Meda, B. C., Rosales-Reynoso, M. A., Puebla-Pérez, A. M., Lemus-Varela, M. L., Garibaldi-Ríos, A. F., Marín-Domínguez, N. A., Pacheco-Verduzco, D. P., & Mohamed-Flores, E. A. (2022). SOD2 Gene Variants (rs4880 and rs5746136) and Their Association with Breast Cancer Risk. Current issues in molecular biology, 44(11), 5221–5233. https://doi.org/10.3390/cimb44110355
Jerotic, D., Matic, M., Suvakov, S., Vucicevic, K., Damjanovic, T., Savic-Radojevic, A., Pljesa-Ercegovac, M., Coric, V., Stefanovic, A., Ivanisevic, J., Jelic-Ivanovic, Z., McClements, L., Dimkovic, N., & Simic, T. (2019). Association of Nrf2, SOD2 and GPX1 Polymorphisms with Biomarkers of Oxidative Distress and Survival in End-Stage Renal Disease Patients. Toxins, 11(7), 431. https://doi.org/10.3390/toxins11070431
Jomova, K., Alomar, S.Y., Alwasel, S.H. et al. Several lines of antioxidant defense against oxidative stress: antioxidant enzymes, nanomaterials with multiple enzyme-mimicking activities, and low-molecular-weight antioxidants. Arch Toxicol 98, 1323–1367 (2024). https://doi.org/10.1007/s00204-024-03696-4
Nikic, P., Dragicevic, D., Jerotic, D., Savic, S., Djukic, T., Stankovic, B., Kovacevic, L., Simic, T., & Matic, M. (2023). Polymorphisms of Antioxidant Enzymes SOD2 (rs4880) and GPX1 (rs1050450) Are Associated with Bladder Cancer Risk or Its Aggressiveness. Medicina (Kaunas, Lithuania), 59(1), 131. https://doi.org/10.3390/medicina59010131
Sonia Vidushi Gupta, Lillian Campos, Kristina Hildegard Schmidt, Mitochondrial superoxide dismutase Sod2 suppresses nuclear genome instability during oxidative stress, Genetics, Volume 225, Issue 2, October 2023, iyad147, https://doi.org/10.1093/genetics/iyad147
rs4880 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs4880
Zou, Y., Grigorian, A., Kennedy, K.G. et al. Differential association of antioxidative defense genes with white matter integrity in youth bipolar disorder. Transl Psychiatry 12, 504 (2022). https://doi.org/10.1038/s41398-022-02261-w
Abdulabbas, H. S., Mohamed, A. H., Al-Imari, M. J., Al-Mawlah, Y. H. & Salah Hashim Shaheed. (2023). The genotypes of glutathione peroxidase 1 (GPx1) (Rs1050450) affect some biomarker levels in the breast cancer patients. Journal Of Biotech Research, 14, 153–159. https://www.btsjournals.com/assets/2023v14p153-159.pdf
Ekoue, D. N., He, C., Diamond, A. M., & Bonini, M. G. (2017). Manganese superoxide dismutase and glutathione peroxidase-1 contribute to the rise and fall of mitochondrial reactive oxygen species which drive oncogenesis. Biochimica et biophysica acta. Bioenergetics, 1858(8), 628–632. https://doi.org/10.1016/j.bbabio.2017.01.006
Jerotic, D., Matic, M., Suvakov, S., Vucicevic, K., Damjanovic, T., Savic-Radojevic, A., Pljesa-Ercegovac, M., Coric, V., Stefanovic, A., Ivanisevic, J., Jelic-Ivanovic, Z., McClements, L., Dimkovic, N., & Simic, T. (2019). Association of Nrf2, SOD2 and GPX1 Polymorphisms with Biomarkers of Oxidative Distress and Survival in End-Stage Renal Disease Patients. Toxins, 11(7), 431. https://doi.org/10.3390/toxins11070431
MRes, A. G. B., PhD. (2023, 3. Oktober). GPX1. Gene Food. https://www.mygenefood.com/genes/longevity-genes/gpx1/
rs1050450 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1050450