Lesedauer: 15 Minuten

Lesedauer: 15 Minuten
Folsäure gehört zu den bekanntesten Vitaminen in der Prävention – insbesondere rund um Schwangerschaft, Herz-Kreislauf-Gesundheit und neurologisches Wohlbefinden. Doch nicht jede Folsäure wirkt gleich. Denn die synthetische Form, wie sie in vielen Nahrungsergänzungsmitteln und angereicherten Lebensmitteln verwendet wird, ist biologisch inaktiv und muss im Körper erst in ihre aktive Form – 5-Methyltetrahydrofolat (5-MTHF) – umgewandelt werden. Der Schlüssel zu diesem biochemischen Prozess liegt im Enzym Methylen-Tetrahydrofolat-Reduktase (MTHFR) – und genau hier entscheidet die individuelle genetische Ausstattung über die tatsächliche Bioverfügbarkeit und Wirksamkeit von Folsäure. Varianten im MTHFR-Gen können die Aktivität dieses Enzyms erheblich beeinflussen und damit erklären, warum manche Menschen trotz ausreichender Folsäurezufuhr funktionelle Mängel entwickeln. In der Folge steigt der Homocysteinspiegel, während zentrale Prozesse wie DNA-Synthese, Zellteilung und Methylierung aus dem Gleichgewicht geraten – mit potenziellen Auswirkungen auf Gefäßgesundheit, Nervensystem und Stoffwechselregulation. Der folgende Beitrag zeigt auf, wie genau der Folatstoffwechsel funktioniert, welche Rolle das MTHFR-Gen dabei spielt, welche genetischen Varianten besonders relevant sind – und wie sich daraus präzise Empfehlungen für eine personalisierte Mikronährstoffstrategie ableiten lassen. Ein essenzielles Thema für alle, die Prävention nicht dem Zufall überlassen wollen.
Folsäure ist die synthetische Form von Vitamin B9 und muss im Körper enzymatisch in die biologisch aktive Form 5-Methyltetrahydrofolat (5-MTHF) umgewandelt werden, um ihre volle Wirkung zu entfalten. Nur 5-MTHF kann am Methylstoffwechsel teilnehmen und kann entscheidend für DNA-Synthese, Zellteilung, Entgiftung und Homocysteinregulation sein.
Die Umwandlung erfolgt über mehrere Zwischenschritte, wobei das Enzym Methylen-Tetrahydrofolat-Reduktase (MTHFR) eine Schlüsselrolle spielt. Eine reduzierte Aktivität dieses Enzyms – z. B. durch genetische Polymorphismen wie rs1801133 oder rs1801131 – kann zu einer unzureichenden Bildung von 5-MTHF führen. In solchen Fällen besteht trotz ausreichender Folsäurezufuhr ein funktioneller Folatmangel.
Für die medizinische Praxis ist wichtig, dass bei Patient:innen mit eingeschränkter MTHFR-Aktivität direkt 5-MTHF supplementiert wird (üblich: 400–800 µg/Tag, bei Bedarf mehr). Ergänzend sollten aktive Formen von Vitamin B12, B6, B2 sowie ggf. Betain (TMG) berücksichtigt werden. Besonders in der Schwangerschaft und bei erhöhtem Homocystein ist dieser Ansatz klinisch relevant, um Methylierungsprozesse, Gefäßgesundheit und neurologische Funktionen zu unterstützen.
Folsäure ist die synthetisch hergestellte Form des Vitamins B9. Sie wird seit vielen Jahren in angereicherten Lebensmitteln und Nahrungsergänzungsmitteln eingesetzt, da sie im Vergleich zu den natürlich vorkommenden Folaten besonders stabil gegenüber Licht, Hitze und Oxidation ist. Im menschlichen Körper übernimmt Vitamin B9 eine Vielzahl lebenswichtiger Funktionen: Es ist zentral an der Zellteilung, DNA- und RNA-Synthese, Blutbildung, dem Aminosäurestoffwechsel sowie an der Methylierung beteiligt. Einem fundamentalen biochemischen Vorgang zur Regulation von Genaktivität, Zellwachstum, Entgiftung und Neurotransmitter-Synthese. Da Folsäure in ihrer synthetischen Form biologisch inaktiv ist, muss sie nach der intestinalen Aufnahme durch mehrere enzymatische Schritte in bioaktive Zwischen- und Endprodukte umgewandelt werden. Dieser Umwandlungsprozess beginnt in der Leber und anderen Geweben und verläuft in mehreren Phasen: Zunächst wird Folsäure durch das Enzym Dihydrofolatreduktase (DHFR) in Dihydrofolat (DHF) und weiter in Tetrahydrofolat (THF) überführt. THF dient als Trägermolekül für sogenannte C1-Gruppen, also chemische Ein-Kohlenstoff-Einheiten, die für zahlreiche Biosynthesen erforderlich sind.
Eine der wichtigsten Zwischenstufen ist 5,10-Methylen-Tetrahydrofolat (5,10-Methylene-THF), das sowohl für die Synthese von Thymidinmonophosphat (dTMP), als auch für die spätere Bildung der aktiven Folatform 5-Methyltetrahydrofolat (5-MTHF) benötigt wird. Letztere ist von besonderer Bedeutung, da sie als einziges Folat-Derivat fähig ist, Homocystein mithilfe des Enzyms Methioninsynthase (MS) in Methionin zu überführen. Methionin wiederum ist die Ausgangssubstanz für S-Adenosylmethionin (SAM), das als universeller Methylgruppendonator an über 100 enzymatischen Reaktionen beteiligt ist. Darunter DNA- und Histonmethylierung, Neurotransmitterstoffwechsel, Hormonaktivierung und Zellmembransynthese.
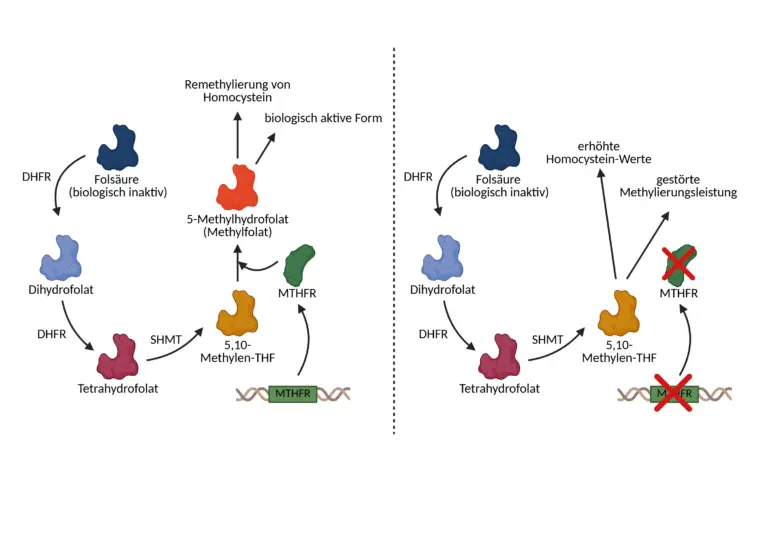
Die Bildung von 5-MTHF aus 5,10-Methylene-THF stellt einen Schlüsselschritt im Folatstoffwechsel dar und wird ausschließlich durch das Enzym Methylen-Tetrahydrofolat-Reduktase (MTHFR) katalysiert. MTHFR ist ein flavinabhängiges Oxidoreduktase-Enzym, das NADPH als Elektronendonor und FAD (Flavin-Adenin-Dinukleotid, abgeleitet aus Vitamin B2) als Cofaktor nutzt, um die Reduktion dieser kritischen Zwischenstufe zu ermöglichen. Die Aktivität von MTHFR bestimmt damit maßgeblich, wie effizient die im Körper vorhandenen oder supplementierten Folate in ihre biologisch relevante Form überführt werden können. Eine verminderte Aktivität des MTHFR-Enzyms, sei es durch genetische Polymorphismen, eingeschränkte Verfügbarkeit von Kofaktoren oder chronischen oxidativen Stress, kann die Umwandlung zu 5-MTHF signifikant reduzieren. Die Konsequenzen sind tiefgreifend: Trotz ausreichender Folsäurezufuhr kann es zu einem funktionellen Folatmangel kommen, da die benötigte aktive Form nicht in ausreichender Menge gebildet wird. Gleichzeitig steigt der Homocysteinspiegel im Plasma an, was in zahlreichen Studien mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen, neurodegenerativen Erkrankungen, Schwangerschaftskomplikationen und psychiatrischen Störungen assoziiert wurde.
Das MTHFR-Gen (Methylen-Tetrahydrofolat-Reduktase) kodiert für das gleichnamige Enzym MTHFR, das eine zentrale Rolle im Folatstoffwechsel und damit in der Umwandlung von inaktiver Folsäure in ihre bioaktive Form spielt. Das Gen ist auf Chromosom 1 am Locus p36.22 (kurzer Arm des Chromosoms) lokalisiert und umfasst etwa 20.000 Basenpaare. Das MTHFR-Enzym ist ein FAD-abhängiges Reduktase-Enzym und benötigt FAD (Flavin-Adenin-Dinukleotid) als prosthetische Gruppe sowie NADPH als Elektronendonator, um seine katalytische Funktion erfüllen zu können.
Folsäure, wie sie in Nahrungsergänzungsmitteln und angereicherten Lebensmitteln enthalten ist, liegt in einer oxidierten, biologisch inaktiven Form vor. Nach der intestinalen Aufnahme wird sie in mehreren Schritten enzymatisch umgewandelt, unter anderem in 5,10-Methylen-Tetrahydrofolat (5,10-Methylene-THF), eine zentrale Zwischenform im Folatstoffwechsel. Die Funktion des MTHFR-Enzyms besteht darin, 5,10-Methylene-THF unter Verbrauch von NADPH zu 5-Methyltetrahydrofolat (5-MTHF) zu reduzieren. Diese Form ist die einzige biologisch aktive Folatform, die zur Remethylierung von Homocystein zu Methionin verwendet werden kann. Die Umwandlung beginnt nach der Aufnahme über den Dünndarm, wobei Folsäure durch spezifische Transporter wie den Protonen-Coupled Folate Transporter (PCFT) ins Blut und weiter in die Leber gelangt. Dort erfolgt die erste Reduktion durch das Enzym Dihydrofolatreduktase (DHFR), bei der unter Verbrauch von NADPH aus Folsäure zunächst Dihydrofolat (DHF) gebildet wird. In einem zweiten Schritt reduziert dasselbe Enzym DHF ebenfalls NADPH-abhängig zu Tetrahydrofolat (THF). THF dient als funktioneller Träger für C1-Gruppen in Form verschiedener Derivate. Für die Umwandlung zu 5-MTHF muss es zunächst in 5,10-Methylen-THF überführt werden. Dies geschieht durch die serinabhängige Reaktion mit dem Enzym Serin-Hydroxymethyltransferase (SHMT), bei der gleichzeitig Glycin entsteht. Cofaktor dieser Reaktion ist Pyridoxalphosphat (PLP), die aktive Form des Vitamins B6. Das so gebildete 5,10-Methylen-THF ist ein zentraler Metabolit im Folatstoffwechsel, da es sowohl für die DNA-Synthese als auch als Vorstufe für 5-MTHF dient. Der entscheidende Schritt zur Aktivierung der Folsäure erfolgt durch das Enzym Methylen-Tetrahydrofolat-Reduktase (MTHFR), da es Elektronen aus NADPH überträgt, um 5,10-Methylen-THF in 5-Methyltetrahydrofolat zu reduzieren. Dabei wird ein Hydridion vom NADPH auf die Methylen-Brücke des Substrats übertragen. Der Flavin-Cofaktor FAD vermittelt diesen Elektronentransfer, wodurch die Doppelbindung in der Methylen-Brücke reduziert und eine stabile Methylgruppe am N5-Atom des Folatmoleküls entsteht. Diese Reduktion ist irreversibel und stellt den finalen Aktivierungsschritt im Folsäurestoffwechsel dar. Das entstandene 5-MTHF ist die wichtigste biologisch aktive Form von Folat im Körper. Es wird in das Blutplasma abgegeben, kann die Blut-Hirn-Schranke passieren und steht dem Körper in allen Geweben für Methylierungsreaktionen zur Verfügung.
Ist die Aktivität des MTHFR-Enzyms eingeschränkt, etwa durch genetische Polymorphismen, oxidativen Stress oder einen Mangel an FAD, kann die Umwandlung von Folsäure zu 5-MTHF nicht in ausreichendem Maß erfolgen. In diesem Fall kann Folsäure trotz guter Versorgung nicht wirksam genutzt werden, was zu einem funktionellen Mangel an bioaktivem Folat führt. Die Folge ist eine unzureichende Remethylierung von Homocystein, ein Rückgang des SAM-Spiegels und eine gestörte Methylierungsleistung auf zellulärer Ebene. Dies kann Auswirkungen auf die Genregulation, die Neurotransmitterproduktion, die Zellteilung sowie die Gefäß- und Nervenfunktion haben.
Damit Folsäure im Körper in ihre biologisch aktive Form 5-Methyltetrahydrofolat (5-MTHF) umgewandelt werden kann, braucht es eine funktionierende Methylen-Tetrahydrofolat-Reduktase, das Enzym, das vom MTHFR-Gen codiert wird. Die Aktivität der MTHFR hängt maßgeblich von der genetischen Struktur des gleichnamigen Gens ab. Zwei genetische Varianten, die dabei besonders gut untersucht sind, sind die Einzelnukleotid-Polymorphismen rs1801133 und rs1801131. Beide beeinflussen die Stabilität und Aktivität des MTHFR-Enzyms, da sie jeweils zu einem Austausch von Aminosäuren führen, der die Enzymstruktur verändert und damit dessen Umwandlungskapazität für Folsäure reduziert.
Im Rahmen der Genanalysen von NovoMedic kann anhand der Kombination dieser beiden Genvarianten die individuelle Fähigkeit zur Umwandlung von Folsäure zu 5-MTHF abgeschätzt werden. Dabei ergeben sich unterschiedliche Genotypkombinationen, die mit klar definierten Aktivitätsniveaus der MTHFR korrelieren. Personen mit der Kombination G/G bei rs1801133 und T/T bei rs1801131 tragen die ursprünglichen Referenzformen beider Genorte. Diese Variante kommt bei etwa 14 % der Bevölkerung vor und geht mit einer vollständigen MTHFR-Aktivität von 100 % einher. Die Umwandlung von Folsäure zu 5-MTHF funktioniert bei diesen Personen effizient, sofern ausreichend Cofaktoren wie Vitamin B2 zur Verfügung stehen. Etwa 25 % der Menschen tragen die Kombination G/G bei rs1801133 und G/T oder T/G bei rs1801131. Diese genetische Konstellation ist mit einer leichten Reduktion der Umwandlungskapazität auf rund 83 % verbunden. Zwar besteht in der Regel kein klinisch relevanter Mangel, dennoch kann bei erhöhtem Bedarf, etwa in der Schwangerschaft oder bei oxidativem Stress, eine gezielte Zufuhr von aktivem Folat sinnvoll sein. Bei etwa 21 % der Bevölkerung liegt der Genotyp G/A oder A/G bei rs1801133 in Kombination mit T/T bei rs1801131 vor. Diese Kombination ist bereits mit einer reduzierten Enzymaktivität von etwa 66 % verbunden. Die Umwandlung synthetischer Folsäure in ihre aktive Form ist dadurch deutlich eingeschränkt, was das Risiko für einen funktionellen Folatmangel erhöht. Rund 20 % der Bevölkerung tragen die sogenannte Compound-Heterozygotie, also G/A oder A/G bei rs1801133 und G/T oder T/G bei rs1801131. In diesen Fällen ist die Aktivität der MTHFR auf nur noch etwa 48 % reduziert. Die Enzymfunktion ist bei beiden Genorten beeinträchtigt, wodurch sich die Fähigkeit zur Umwandlung von Folsäure zu 5-MTHF deutlich verschlechtert. Eine direkte Supplementierung mit 5-MTHF wird in diesen Fällen klar empfohlen, um die Homocysteinregulation und die Methylierungsvorgänge im Körper zu stabilisieren. Eine weitere Variante, die bei etwa 9 % der Bevölkerung auftritt, ist G/G bei rs1801133 und G/G bei rs1801131. Auch hier ist die Aktivität des Enzyms signifikant reduziert auf etwa 61 % der ursprünglichen Funktion. Unter Alltagsbedingungen kann das zu einer verminderten Bioverfügbarkeit von aktivem Folat führen, was sich insbesondere bei gleichzeitigem erhöhtem Bedarf oder Belastung negativ auf die Stoffwechsellage auswirkt. Die genetisch kritischste Konstellation betrifft Personen mit dem Genotyp A/A bei rs1801133 und T/T bei rs1801131. Eine Kombination, die bei etwa 11 % der Bevölkerung vorkommt. In diesen Fällen ist die Aktivität der MTHFR drastisch auf nur noch 25 % reduziert. Die Umwandlung von Folsäure zu 5-MTHF ist stark eingeschränkt, wodurch ein funktioneller Folatmangel selbst bei ausreichender Folsäurezufuhr entstehen kann. Diese Personen haben ein deutlich erhöhtes Risiko für eine chronisch gestörte Methylierungsleistung, erhöhte Homocysteinspiegel und potenziell damit assoziierte Folgeerkrankungen wie Herz-Kreislauf-Probleme, Erschöpfungszustände, neurologische Symptome oder auch epigenetische Dysbalancen.
Die Kenntnis des individuellen MTHFR-Genotyps bietet eine wertvolle Grundlage für eine personalisierte Mikronährstoffstrategie. Ein funktioneller Folatmangel wird besonders kritisch in Lebensphasen mit erhöhtem Bedarf, etwa während der Schwangerschaft. Ausreichend aktives Folat ist essenziell für die embryonale Entwicklung, insbesondere zur Vermeidung von Neuralrohrdefekten. Auch bei Kinderwunsch sollte daher frühzeitig auf eine gezielte Supplementierung mit 5-MTHF gesetzt werden, da Frauen mit eingeschränkter MTHFR-Aktivität Folsäure nur unzureichend umwandeln können. Anders als synthetische Folsäure kann 5-MTHF vom Körper direkt genutzt werden, ohne auf die enzymatische Aktivierung angewiesen zu sein. Es stellt somit die sicherere und effektivere Option dar – sowohl zur Prävention als auch zur Therapie eines Mangels.
Je nach genetischer Ausgangslage, Laborwerten (z. B. Homocystein, SAM/SAH-Ratio, Vollblutfolat) und klinischer Symptomatik liegt die empfohlene Tagesdosis von 5-Methyltetrahydrofolat typischerweise im Bereich von 400 bis 800 µg, bei diagnostiziertem Mangel oder in der Schwangerschaft kann sie auch auf 1.000 µg oder mehr erhöht werden. Eine parallele Versorgung mit Vitamin B12 in seiner aktiven Form (Methylcobalamin) sowie Vitamin B6 (Pyridoxal-5-Phosphat) ist sinnvoll, da diese Nährstoffe im eng gekoppelten Homocystein- und Methylstoffwechsel ebenfalls unverzichtbar sind. Auch Vitamin B2 (Riboflavin) sollte berücksichtigt werden, da es als Kofaktor der MTHFR selbst wirkt und die Enzymaktivität unterstützen kann. Bei stark erhöhtem Homocysteinwert kann zusätzlich Betain (TMG) ergänzt werden, ein alternativer Methylgruppendonor, der unabhängig von Folat und B12 wirkt.
Neben der Mikronährstoffversorgung spielt auch die Ernährung eine zentrale Rolle. Besonders folatreiche Lebensmittel sind dunkelgrünes Blattgemüse wie Spinat, Mangold und Rucola, außerdem Brokkoli, Avocado, Spargel und Hülsenfrüchte. Auch Leber ist eine sehr gute Quelle, sollte in der Schwangerschaft allerdings nur in Maßen konsumiert werden. Stark verarbeitete Produkte, Alkohol, Rauchen und übermäßiger Kaffeekonsum sollten möglichst reduziert werden, da sie die Aufnahme und Verwertung von Mikronährstoffen negativ beeinflussen können.
Zusammenfassend lässt sich sagen: Die Kombination aus genetischer Diagnostik, gezielter Supplementierung bioaktiver Mikronährstoffe, nährstoffreicher Ernährung und einem ganzheitlich gesundheitsfördernden Lebensstil stellt einen äußerst wirkungsvollen und wissenschaftlich fundierten Ansatz zur Prävention und Behandlung eines funktionellen Folatmangels dar. Besonders bei eingeschränkter MTHFR-Aktivität kann dieses integrative Vorgehen einen entscheidenden Beitrag zur Stabilisierung des Methylstoffwechsels, zur Normalisierung des Homocysteinspiegels und zur langfristigen Gesundheitsförderung leisten, individuell angepasst und alltagsnah umsetzbar.
Flexikon DocCheck. (n.d.). Folsäure. https://flexikon.doccheck.com/de/Fols%C3%A4ure
Lipiński, P. (2016). Folic acid supplementation in patients with mutations in the MTHFR gene. Polish Annals of Medicine, 23(2), 167–171. https://www.mp.pl/paim/issue/article/15039/
Lipiński, P. (2016). Folic acid supplementation in patients with mutations in the MTHFR gene. Polish Annals of Medicine, 23(2), 167–171. https://www.mp.pl/paim/issue/article/15039/
Borràs, C., et al. (2020). Folate, MTHFR gene polymorphisms, and vitamin B12 levels in major depressive disorder. Journal of Clinical Medicine, 9(9), 2836. https://www.mdpi.com/2077-0383/9/9/2836
Centers for Disease Control and Prevention (CDC). (2023). MTHFR gene, folic acid, and pregnancy. https://www.cdc.gov/folic-acid/data-research/mthfr/index.html
Genetic Home Reference / NIH. (n.d.). rs1801131 (MTHFR variant). https://www.snpedia.com/index.php/Rs1801131
Genetic Home Reference / NIH. (n.d.). rs1801133 (MTHFR C677T). https://www.snpedia.com/index.php/Rs1801133
MGZ – Medizinisch Genetisches Zentrum. (n.d.). MTHFR-Mutation. https://www.mgz-muenchen.de/erkrankungen/diagnose/methylen-tetrahydrofolat-reduktase-mthfr-mutation.html
MyGeneFood. (2023). MTHFR and folic acid build-up: What you need to know. https://www.mygenefood.com/blog/mthfr-and-folic-acid-build-up-what-you-need-to-know (MTHFR)
Pereira, A. C., et al. (2022). Role of folic acid and genetic polymorphisms in cardiovascular disease: Review. The Journal of Nutritional Biochemistry, 107, 109064. https://www.sciencedirect.com/science/article/pii/S0022316622089611
Pu, D., et al. (2017). Association between MTHFR gene polymorphism and neural tube defects. Journal of Clinical Neuroscience, 44, 81–86. https://pubmed.ncbi.nlm.nih.gov/28587068/
Ranjbar, M., et al. (2022). DNA methylation and MTHFR gene polymorphisms in depression: A systematic review. Psychiatry Research, 311, 114495. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9380836/
Sánchez-Muñoz-Torrero, J. F., et al. (2024). Maternal folic acid intake and MTHFR variants in fetal development. Genes, 15(2), 256. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10779094/
Schizophrenia Working Group of the Psychiatric Genomics Consortium. (2018). Association of MTHFR gene variants with schizophrenia. Translational Psychiatry, 8, Article 124. https://www.nature.com/articles/s41398-018-0276-6
Sibbing, D., et al. (2022). MTHFR 677TT genotype and cardiovascular risk: Role of folate status. International Journal of Molecular Sciences, 25(13), 6924. https://www.mdpi.com/1422-0067/25/13/6924
Trewin, A. L. (2015). Folic acid vs. 5-MTHF: Treating MTHFR deficiency. MTHFR Support Australia. https://mthfrsupport.com.au/2015/05/folic-acid-vs-5-mthf-treating-mthfr-deficiency/