Lesedauer: 15 Minuten

Lesedauer: 15 Minuten

Coenzym Q10 ist weit mehr als nur ein populäres Nahrungsergänzungsmittel – es bildet einen zentralen molekularen Knotenpunkt zwischen Energiegewinnung und antioxidativem Schutz. Als essenzieller Elektronenträger der mitochondrialen Atmungskette ist CoQ10 entscheidend an der Synthese von ATP beteiligt, der universellen Zellenergie. Gleichzeitig schützt seine reduzierte Form, Ubichinol, empfindliche Zellstrukturen vor oxidativem Stress – eine Schutzfunktion, die insbesondere in hochaktiven Geweben wie Herz, Gehirn und Muskulatur von großer Bedeutung ist. Für die volle biologische Wirksamkeit ist jedoch eine effiziente Umwandlung von Ubichinon zu Ubichinol erforderlich – ein Prozess, der maßgeblich durch das Enzym NQO1 (NAD(P)H Chinon-Dehydrogenase 1) gesteuert wird. Die Aktivität dieses Enzyms hängt wiederum von genetischen Faktoren ab: Bestimmte Varianten im NQO1-Gen können die Fähigkeit zur Reduktion von CoQ10 erheblich beeinflussen – mit direkten Auswirkungen auf Zellschutz, Leistungsfähigkeit und therapeutische Wirksamkeit von CoQ10-Präparaten. Der folgende Beitrag beleuchtet die biochemischen Grundlagen, die genetischen Varianten und deren Bedeutung für eine personalisierte Mikronährstoffstrategie bei mitochondrialem Stress, chronischer Erschöpfung und kardiometabolischer Belastung.
Coenzym Q10 (CoQ10) ist ein zentrales Redoxmolekül in der mitochondrialen Atmungskette und wirkt in seiner reduzierten Form (Ubichinol) zusätzlich als potentes lipophiles Antioxidans. Die kontinuierliche Umwandlung zwischen Ubichinon und Ubichinol ist essenziell für Energieproduktion und antioxidativen Zellschutz.
Die enzymatische Reduktion von Ubichinon zu Ubichinol erfolgt primär über NQO1 (NAD(P)H Chinon-Dehydrogenase 1). Dieses Enzym katalysiert eine sichere zweielektronische Reduktion und verhindert so die Bildung schädlicher Zwischenprodukte wie Semichinonradikale oder Superoxide.
Für die medizinische Praxis ist wichtig, dass genetische Variationen im NQO1-Gen die enzymatische Aktivität deutlich beeinflussen können. Eine eingeschränkte Funktion reduziert die Fähigkeit zur Umwandlung von Ubichinon zu Ubichinol, was die Wirksamkeit von herkömmlichen CoQ10-Präparaten mindern kann. In solchen Fällen ist die Supplementation mit Ubichinol – der bioaktiven Form – therapeutisch sinnvoll, insbesondere bei mitochondrialer Dysfunktion, oxidativem Stress oder chronischer Erschöpfung. Die Kombination mit Cofaktoren wie NADH, Vitamin C/E, Glutathion und Selen unterstützt zusätzlich die Redoxbalance und mitochondriale Stabilität.
Coenzym Q10 (CoQ10), chemisch bezeichnet als 2,3-Dimethoxy-5-methyl-6-decaprenyl-benzochinon, ist ein lipophiles Chinonmolekül, das in nahezu allen Zellmembranen präsent ist. Seine höchste funktionelle Dichte liegt in der inneren Mitochondrienmembran, wo es eine unverzichtbare Rolle in der oxidativen Phosphorylierung spielt. Dort ist Coenzym Q10 unentbehrlich für die Funktion der Atmungskette, ein mehrstufiger Prozess, bei dem die in Nährstoffen gespeicherte Energie in die universell einsetzbare Zellenergie Adenosintriphosphat (ATP) umgewandelt wird.
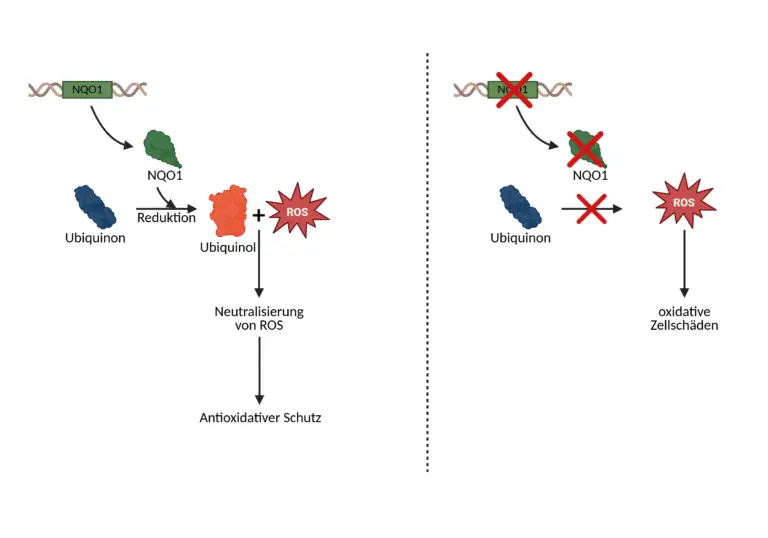
In seiner oxidierten Form, Ubichinon, nimmt CoQ10 Elektronen aus den Stoffwechselreaktionen der Zelle auf und transportiert sie innerhalb der inneren Mitochondrienmembran weiter zu nachgeschalteten Enzymkomplexen. Bei dieser Übertragung wird Ubichinon in die reduzierte Form Ubichinol überführt. Diese Form gibt die Elektronen wieder ab und ermöglicht damit die schrittweise Energiegewinnung, die letztlich zur Herstellung von ATP führt. Besonders energiehungrige Organe wie das Herz, die Muskulatur, das Gehirn und die Leber sind auf diesen Ablauf in hohem Maß angewiesen. Parallel zur Funktion im Energiestoffwechsel übernimmt CoQ10 in seiner reduzierten Form, Ubichinol, eine ausgeprägte antioxidative Rolle. Es zählt zu den effektivsten lipophilen Antioxidantien im Organismus und ist in der Lage, reaktive Sauerstoffspezies (ROS) zu neutralisieren. Ubichinol schützt insbesondere lipidreiche Strukturen wie Zellmembranen und mitochondriale Membranen vor oxidativen Schädigungen und kann zusätzlich oxidierte Formen anderer Antioxidantien wie Vitamin E (α-Tocopherol) regenerieren. Für die Umsetzung dieser Funktionen ist die kontinuierliche Umwandlung zwischen Ubichinon und Ubichinol erforderlich, ein Prozess, der maßgeblich durch NQO1 (NAD(P)H Chinon-Dehydrogenase 1) ermöglicht wird. NQO1 ist ein zytosolisches Flavoprotein, das eine Reduktion von Ubichinon zu Ubichinol katalysiert. Diese Reduktion ist nicht nur für die antioxidative Aktivierung von CoQ10 entscheidend, sondern minimiert gleichzeitig die Bildung potenziell schädlicher Zwischenformen wie Semichinone oder Superoxid-Anionen, die bei einer Reduktion entstehen würden.
Das NQO1-Gen, das für dieses Enzym kodiert, ist somit ein zentraler molekularer Faktor in der Regulation der antioxidativen Leistungsfähigkeit von CoQ10. Die Expression und Funktionalität dieses Gens beeinflussen direkt, in welchem Ausmaß Ubichinon effizient in Ubichinol überführt werden kann und damit auch, ob supplementiertes CoQ10 in oxidierter Form überhaupt seine volle biologische Wirkung entfalten kann. Die Aktivität von NQO1 ist dabei abhängig von zellulären Redoxzuständen, vom Alter, bestimmten Nährstoffverfügbarkeiten sowie von genetischer Variation. Ein funktionell aktives NQO1-System sichert somit nicht nur die Bioverfügbarkeit von CoQ10, sondern trägt auch wesentlich zur Stabilität der mitochondrialen Redoxumgebung bei. Umgekehrt kann eine eingeschränkte Enzymaktivität die Fähigkeit zur Bildung von Ubichinol vermindern, mit möglichen Folgen für Zellschutz, Energieproduktion und systemische Resilienz gegenüber oxidativem Stress.
Zusammengefasst stellt Coenzym Q10 ein zentrales Redoxmolekül dar, das auf molekularer Ebene sowohl für die Synthese zellulärer Energie als auch für den Schutz vor oxidativen Zellschäden verantwortlich ist. Die enzymatische Unterstützung durch NQO1 ist dabei ein kritischer Faktor, der die Umwandlung in die antioxidativ wirksame Form ermöglicht und so die Gesamtwirkung von CoQ10 im Organismus entscheidend mitbestimmt. Dieses fein abgestimmte Zusammenspiel unterstreicht die Bedeutung einer individuell abgestimmten Mikronährstoffversorgung zur Unterstützung mitochondrialer Funktion und zellulärer Vitalität.
Das NQO1-Gen (NAD(P)H Chinon-Dehydrogenase 1) kodiert für das gleichnamige Enzym NQO1, das eine zentrale Rolle im zellulären Redoxhaushalt und bei der Bioaktivierung von Chinonverbindungen spielt. Das Gen ist auf Chromosom 16 an der Position q22.1 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 20.000 Basenpaare. Das von NQO1 codierte Enzym ist ein zytosolisches Flavoprotein, das FAD (Flavin-Adenin-Dinukleotid) als prosthetische Gruppe benötigt und unter Verbrauch des Reduktionsäquivalents NADH oder NADPH arbeitet.
Die Reduktion von Ubichinon zu Ubichinol stellt einen zentralen biochemischen Vorgang dar, der sowohl für die mitochondriale Energieproduktion als auch für den Schutz vor oxidativem Stress von entscheidender Bedeutung ist. Coenzym Q10, auch als Ubichinon bezeichnet, ist ein Chinonmolekül mit einem lipophilen Seitenkettenrest, der es ihm ermöglicht, sich in biologischen einzulagern. Dort übernimmt es im Rahmen der Atmungskette die Funktion eines mobilen Elektronenträgers und pendelt zwischen oxidierter (Ubichinon) und reduzierter (Ubichinol) Form. Die Fähigkeit, zwischen diesen beiden Redoxzuständen zu wechseln, ist die Grundlage seiner biologischen Wirksamkeit. Der Umwandlungsprozess von Ubichinon in Ubichinol erfolgt über die Übertragung von zwei Elektronen und zwei Protonen auf den aromatischen Chinonring. Diese Reaktion wird unter physiologischen Bedingungen hauptsächlich durch das Enzym NAD(P)H Chinon-Dehydrogenase 1, kurz NQO1, katalysiert. Im ersten Schritt reduziert NAD(P)H das FAD im aktiven Zentrum des Enzyms zu FADH₂. Diese reduzierte Form des Flavins überträgt anschließend zwei Elektronen auf Ubichinon. Parallel dazu werden zwei Protonen aus dem zellulären Milieu aufgenommen, sodass letztlich Ubichinol, die vollständig reduzierte, antioxidativ wirksame Form des Moleküls, entsteht. Besonders bemerkenswert an diesem Prozess ist, dass NQO1 eine sogenannte zweielektronische Reduktion vermittelt. Das bedeutet, dass Ubichinon in einem einzigen, koordinierten Reaktionsschritt zu Ubichinol überführt wird, ohne dass eine instabile Zwischenform, das sogenannte Semichinon-Radikal, entsteht. Diese Reduktionsstrategie ist ein hochentwickelter zellulärer Schutzmechanismus: Würde die Reduktion über eine einzelektronische Übertragung ablaufen, wie sie z. B. durch Cytochrom-P450-Reduktasen erfolgen kann, entstünde ein Semichinon-Radikal. Dieses kann in Anwesenheit von molekularem Sauerstoff Superoxid-Radikale bilden, die zu oxidativem Stress, Lipidperoxidation und mitochondrialer Dysfunktion führen. Durch die kontrollierte zweielektronische Reaktion verhindert NQO1 die Bildung solcher reaktiven Zwischenprodukte und schützt die Zelle gezielt vor radikalvermittelten Schädigungen. Das entstehende Ubichinol verbleibt in der Membran und übernimmt dort seine antioxidativen Aufgaben. Es ist in der Lage, freie Radikale, insbesondere Lipidperoxid-Radikale, zu neutralisieren und so die Kettenreaktionen der Lipidperoxidation zu unterbrechen. Dabei wird Ubichinol selbst wieder zu Ubichinon oxidiert, sodass ein kontinuierlicher Redoxzyklus entsteht. Die Wiederherstellung der reduzierten Form, also die erneute Reduktion zu Ubichinol, ist notwendig, um die Schutzfunktion aufrechtzuerhalten. Dieser Kreislauf läuft unter physiologischen Bedingungen fortwährend ab und ist in Phasen erhöhten oxidativen Stresses oder hoher mitochondrialer Aktivität besonders ausgeprägt.
Störungen im NQO1-System – etwa durch Veränderungen in der Genaktivität oder funktionelle Einschränkungen auf Enzymebene – können weitreichende Auswirkungen haben, darunter eine erhöhte Empfindlichkeit gegenüber oxidativen Zellschäden, eine verringerte Wirksamkeit von Coenzym Q10 in der Nahrungsergänzung sowie eine gestörte Regulation von zellulären Entgiftungsvorgängen. Entsprechend nimmt NQO1 eine Schlüsselfunktion in der funktionellen Zellbiologie und der personalisierten Mikronährstoffversorgung ein.
Damit Ubichinon im Körper zuverlässig in die biologisch aktive, antioxidativ wirksame Form Ubichinol umgewandelt werden kann, ist die Aktivität des Enzyms NQO1 (NAD(P)H Chinon-Dehydrogenase 1) von zentraler Bedeutung. Das von NQO1 codierte Enzym ist dafür verantwortlich, Ubichinon unter Verbrauch von NADH oder NADPH zweielektronisch zu reduzieren, ein hochregulierter Vorgang, der entscheidend dafür ist, dass Coenzym Q10 seine antioxidativen Schutzfunktionen überhaupt erfüllen kann. Diese enzymatische Umwandlung erfolgt sicher und effizient nur dann, wenn die Struktur des Enzyms intakt ist. Eine genetische Veränderung im NQO1-Gen, insbesondere am Einzelnukleotid-Polymorphismus (SNP) rs1800566, kann die Funktionsfähigkeit dieses Schutzmechanismus erheblich beeinflussen. Bei diesem SNP wird die Base Guanin (G) durch Adenin (A) ausgetauscht, was zu einer Veränderung der Aminosäuresequenz führt: Anstelle von Prolin wird an einer bestimmten Stelle im Enzym Serin eingebaut. Dieser Austausch kann die dreidimensionale Struktur und Stabilität des Enzyms verändern, mit teils deutlichen Auswirkungen auf dessen Aktivität.
Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung des NQO1-Genotyps (G/G, G/A oder A/G und A/A) die individuelle Veranlagung zur Umwandlungsfähigkeit von Ubichinon zu Ubichinol erfasst werden. Beim häufigsten Genotyp G/G, der in etwa 51 % der Bevölkerung vorkommt, liegt die ursprüngliche, funktionell intakte Enzymstruktur auf beiden Allelen vor. Die Dehydrogenase arbeitet hier voll funktionsfähig. Das bedeutet: Ubichinon kann effizient in Ubichinol überführt werden, wodurch sowohl die antioxidative Kapazität als auch die Bioverfügbarkeit von Coenzym Q10 optimal sichergestellt sind. Bei der heterozygoten Genvariante G/A oder A/G, die etwa 40 % der Bevölkerung tragen, ist eines der beiden Allele verändert. Die Folge ist in der Regel eine verringerte Stabilität und reduzierte Aktivität des Enzyms, was zu einer verminderten Reduktionsrate von Ubichinon zu Ubichinol führen kann. Personen mit dieser Variante können Coenzym Q10 aus oxidierten Quellen weniger effizient aktivieren. Insbesondere bei erhöhtem Bedarf (z. B. bei oxidativem Stress, erhöhter körperlicher Belastung oder mitochondrialer Dysfunktion) empfiehlt sich in diesen Fällen die gezielte Zufuhr von Ubichinol, also der bereits reduzierten Form, um die volle Wirksamkeit sicherzustellen. Bei der Genvariante A/A, die etwa 9 % der Bevölkerung betrifft, liegt die Veränderung auf beiden Allelen vor. In diesem Fall ist die enzymatische Aktivität von NQO1 stark eingeschränkt oder vollständig aufgehoben. Das bedeutet: Der Körper ist kaum in der Lage, Ubichinon in die antioxidativ aktive Form Ubichinol umzuwandeln. Die Folge kann eine eingeschränkte antioxidative Kapazität, ein erhöhtes Risiko für oxidative Zellschäden und eine geringere Wirksamkeit von Ubichinon-haltigen Nahrungsergänzungsmitteln sein. Betroffene Personen sollten auf eine gezielte Zufuhr von Ubichinol achten, um eine direkte Verfügbarkeit der aktiven Form sicherzustellen. Darüber hinaus kann es sinnvoll sein, den körpereigenen Reduktionsstatus mit unterstützenden Mikronährstoffen wie NADH, Vitamin C, Selen oder Glutathion zu fördern.
Die Analyse des NQO1-Gens (rs1800566) liefert wertvolle Hinweise darauf, wie gut der Körper in der Lage ist, Coenzym Q10 in seine biologisch aktive Form Ubichinol umzuwandeln. Insbesondere bei Patient:innen mit chronischer Erschöpfung, kardiovaskulären Belastungen, neurodegenerativen Symptomen, eingeschränkter Leistungsfähigkeit oder mitochondrialer Dysfunktion kann die genetische Information zur NQO1-Aktivität gezielt für eine personalisierte Mikronährstoffstrategie genutzt werden.
Personen mit einer genetisch reduzierten NQO1-Aktivität, vor allem bei Vorliegen des Genotyps A/A, können diese Umwandlung nicht effizient durchführen. In solchen Fällen empfiehlt sich in der Praxis die gezielte Zufuhr von Ubichinol, also jener Form, die ohne enzymatische Reduktion direkt bioaktiv vorliegt. Eine tägliche Dosierung von 100 bis 300 mg Ubichinol hat sich in der therapeutischen Anwendung als wirkungsvoll erwiesen, wobei die genaue Dosis individuell an Bedarf und Beschwerdebild angepasst werden sollte. Begleitend ist eine ausreichende Versorgung mit unterstützenden Mikronährstoffen sinnvoll, insbesondere mit NADH, Vitamin C, Vitamin E, Selen und Glutathion, da sie als Cofaktoren bzw. Reduktionsmittel zur Stabilisierung der körpereigenen Redoxbalance beitragen. Auch Magnesium und Zink sollten berücksichtigt werden, da sie strukturell und funktionell an zahlreichen Enzymprozessen beteiligt sind, die indirekt die Mitochondrienfunktion beeinflussen.
Neben der Supplementierung spielt auch die Ernährung eine tragende Rolle: Für eine natürliche Unterstützung der mitochondrialen Aktivität und des antioxidativen Systems empfiehlt sich der vermehrte Verzehr von Lebensmitteln mit hohem Gehalt an Q10, etwa fetter Fisch (Makrele, Lachs, Sardinen), Innereien (v. a. Herz und Leber), Nüssen, Brokkoli und Spinat. Zusätzlich können fermentierte Lebensmittel wie Sauerkraut oder Kefir die Aufnahme von bioaktiven Coenzymen und Enzymaktivität im Darm positiv beeinflussen.
Insgesamt bietet die genetische Information zum NQO1-Status eine hervorragende Grundlage, um präventive und therapeutische Maßnahmen zielgerichtet auf die mitochondriale Ausgangslage abzustimmen. Besonders im Kontext chronischer Erschöpfung, neurologischer Dysregulation oder systemischer Entzündungsprozesse kann eine personalisierte Mikronährstoffversorgung auf Basis der NQO1-Aktivität ein entscheidender Faktor für Regeneration, Zellschutz und langfristige Energie- und Leistungsfähigkeit sein. Auch für die ärztliche Begleitung ergibt sich daraus ein greifbarer Mehrwert: durch klare Entscheidungshilfen, verständliche Zusammenhänge und eine hohe therapeutische Akzeptanz bei Patient:innen, die aktiv in ihre Gesundheitsentwicklung eingebunden werden.
Begum, N. A., et al. (2011). NQO1 and cancer: An overview. Chinese Journal of Cancer, 30(2), 98–103. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3178961/
Benhar, M., & Engelberg, D. (2011). The antioxidant and cytoprotective enzyme NQO1: A target for novel chemopreventive and chemotherapeutic strategies. Free Radical Biology and Medicine, 51(7), 1372–1381. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3160390/
Buryanovskyy, L., et al. (2004). Crystal structure of quinone reductase 2 in complex with resveratrol. Proceedings of the National Academy of Sciences, 101(47), 17090–17095. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC529939/
Cancer Research UK. (2013). NQO1 C609T polymorphism and cancer susceptibility: Meta-analysis results. British Journal of Cancer, 109(7), 1914–1922. https://www.nature.com/articles/bjc2013357
Genecards. (n.d.). NQO1 gene: NAD(P)H quinone dehydrogenase 1. https://www.genecards.org/cgi-bin/carddisp.pl?gene=NQO1
Lee, H. R., et al. (2018). NAD(P)H: Quinone oxidoreductase 1 polymorphism and cancer risk: A meta-analysis. Oncotarget, 9(16), 13215–13227. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5807419/
NCBI Gene. (n.d.). NQO1 NAD(P)H quinone dehydrogenase 1. https://www.ncbi.nlm.nih.gov/gene/1728
NCBI Genetics Home Reference. (2018). NQO1 gene. In MedlinePlus Genetics. https://www.ncbi.nlm.nih.gov/books/NBK531491/
SNPedia. (n.d.). Rs1800566 (NQO1). https://www.snpedia.com/index.php/Rs1800566
Tsai, S. M., et al. (2022). The NQO1 enzyme protects against oxidative stress-induced cellular senescence. Oxidative Medicine and Cellular Longevity, 2022, 1–12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9627178/
Zhang, Y., et al. (2020). NAD(P)H:Quinone oxidoreductase 1 in cancer therapy and prevention. Frontiers in Pharmacology, 11, 1248. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6921033/
Bažanov, B., & Kisková, T. (2021). Coenzyme Q10 in the treatment of mitochondriopathies and neurodegenerative diseases. Life, 11(12), 1301. https://www.mdpi.com/2075-1729/11/12/1301
DocCheck Flexikon. (n.d.). Ubichinon. https://flexikon.doccheck.com/de/Ubichinon
IndyVit. (n.d.). Ubiquinol vs. Ubiquinon – Eine umfassende Untersuchung der Coenzym Q10-Formen. https://indyvit.com/blogs/neues/ubiquinol-vs-ubiquinon-eine-umfassende-untersuchung-der-coenzym-q10-formen
Kaneka Nutrients & Natural Medicine Journal. (n.d.). How genetics can affect the body’s use of CoQ10 and Ubiquinol. https://www.naturalmedicinejournal.com/blog/how-genetics-can-affect-bodys-use-coenzymeq10-and-ubiquinol-sponsored-kaneka
Saini, R. (2015). Coenzyme Q10: The essential nutrient. International Journal of Clinical Biochemistry and Research, 2(4), 217–220. https://www.sciencedirect.com/science/article/abs/pii/S2210778916303786
Tanaka, K., et al. (2020). Mitochondrial-targeted antioxidant therapy in sepsis: A review. Journal of Inflammation Research, 13, 471–485. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8027776/
Xcode Life. (n.d.). Coenzyme Q10 Supplements: Genes that influence your requirements. https://www.xcode.life/genes-and-nutrition/coenzyme-q10-supplements-genes-requirements/