Lesedauer: 15 Minuten

Lesedauer: 15 Minuten
Eisen ist ein zentrales Spurenelement für Sauerstofftransport, Zellatmung und zahlreiche enzymatische Prozesse. Die intestinale Eisenresorption erfolgt im oberen Dünndarm über spezifische Transporter, wird aber primär systemisch durch das Leberhormon Hepcidin gesteuert. Die Regulation der Hepcidinproduktion hängt unter anderem vom HFE-Gen ab, das bei bestimmten Genvarianten in seiner Funktion eingeschränkt ist. Dies kann zu einer unkontrollierten Eisenaufnahme und zur Entwicklung einer Hämochromatose führen – einer klinisch relevanten Eisenüberladung mit Organbeteiligung. Der folgende Beitrag beschreibt die physiologischen Grundlagen der Eisenaufnahme, die Rolle des HFE-Gens in der Systemregulation sowie praktische Implikationen für Screening und Risikobewertung in der ärztlichen Betreuung.
Eisen ist essenziell für Sauerstofftransport, Zellatmung, DNA-Synthese und Immunabwehr. Es wird ausschließlich über die Nahrung aufgenommen, wobei tierisches Hämeisen besser resorbiert wird als pflanzliches Nicht-Hämeisen. Die Resorption erfolgt im Duodenum über spezialisierte Transporter (DMT1, HCP1) und wird über das Hormon Hepcidin fein reguliert.
Das HFE-Gen steuert die Hepcidinproduktion und damit die Eisenaufnahme. Genetische Varianten, insbesondere rs1800562 (C282Y), können diesen Regulationsmechanismus stören. Folge kann eine unkontrollierte Eisenresorption sein, die zur Eisenüberladung (Hämochromatose) führen kann – mit Risiken für Leber, Herz, Pankreas und andere Organe.
Betroffene Personen lagern überschüssiges Eisen ein, was oxidativen Stress und entzündliche Gewebeschäden fördern kann. Die Symptome reichen von Erschöpfung über Leberfunktionsstörungen bis zu Diabetes und Herzrhythmusstörungen – oft erst spät erkannt.
Für die medizinische Praxis ist wichtig, dass bei Risikopatient:innen mit genetischer Prädisposition (v. a. C282Y-Homozygote) Eisenstatus und Ferritinwerte regelmäßig kontrolliert und ggf. die Eisenzufuhr begrenzt werden. Frühzeitige Diagnostik durch HFE-Gentestung ermöglicht eine effektive Prävention schwerwiegender Folgeerkrankungen.
Eisen ist ein lebensnotwendiges Spurenelement, das in nahezu allen biologischen Systemen eine zentrale Rolle spielt. Es handelt sich um ein sogenanntes Übergangsmetall, das in der Lage ist, Elektronen zu übertragen, wodurch es prädestiniert ist für zahlreiche redoxaktive Prozesse im menschlichen Organismus. Diese Eigenschaft macht Eisen unersetzlich für fundamentale Funktionen wie den Sauerstofftransport, die Zellatmung, die DNA-Synthese sowie für immunologische, neurologische und hormonelle Prozesse. Trotz seiner geringen absoluten Menge im Körper, durchschnittlich etwa drei bis fünf Gramm bei einem Erwachsenen, ist Eisen für das Überleben und die Funktionalität jeder einzelnen Zelle essenziell. Aufgrund seines Potenzials, oxidative Schäden zu verursachen, ist der Körper darauf angewiesen, Eisen streng zu kontrollieren, es überwiegend protein-gebunden zu transportieren und zu speichern und den Eisenstoffwechsel feinfühlig zu regulieren.
Ein erheblicher Teil des Gesamteisens ist funktionell eingebunden: Rund 60–70 % befinden sich im Hämoglobin der Erythrozyten, wo Eisen in Form von zweiwertigem Eisen (Fe²⁺) zentral in der Häm-Gruppe eingebettet ist und eine reversible Sauerstoffbindung ermöglicht. Weitere 10 % des Eisens sind im Myoglobin gespeichert, einem sauerstoffbindenden Protein der Muskelzellen, insbesondere in Herz- und Skelettmuskulatur. Etwa 15–20 % des Eisens liegen in Speicherformen vor, primär als Ferritin und bei Überladung auch als Hemosiderin, hauptsächlich in der Leber, der Milz und dem Knochenmark. Ein kleiner, aber biologisch hochrelevanter Anteil des Eisens ist an Enzyme gebunden, die zentrale Funktionen in der mitochondrialen Atmungskette (z. B. Cytochrome, Eisen-Schwefel-Komplexe), der Entgiftung (z. B. Cytochrom P450), der DNA-Replikation (z. B. Ribonukleotid-Reduktase) oder der Neurotransmittersynthese (z. B. Tyrosin-Hydroxylase) übernehmen. Der freie, „nicht gebundene“ Eisenpool im Plasma ist extrem gering, da ungebundenes Eisen hochreaktiv ist und die Bildung freier Radikale über Fenton-Reaktionen katalysieren kann, was potenziell zelltoxisch wirkt.
Die Aufnahme von Eisen in den Körper erfolgt ausschließlich über die Nahrung und ist abhängig von Form, Matrix und Begleitstoffen der jeweiligen Lebensmittel. Grundsätzlich wird zwischen zwei Formen unterschieden: Hämeisen, das überwiegend in tierischen Produkten (z. B. Fleisch, Innereien) vorkommt und als Bestandteil der Häm-Gruppe direkt und effizient über spezifische Transportmechanismen aufgenommen wird, sowie Nicht-Hämeisen, das in pflanzlichen Quellen enthalten ist und in seiner dreiwertigen Form (Fe³⁺) zunächst durch Reduktasen im Darm in die zweiwertige, absorbierbare Form (Fe²⁺) umgewandelt werden muss. Die Aufnahme von Hämeisen liegt typischerweise bei etwa 15–35 %, während Nicht-Hämeisen mit einer Aufnahmequote von 2–20 % deutlich variabler ist und stark durch andere Nahrungsbestandteile beeinflusst wird. Positiv wirken sich unter anderem Vitamin C, organische Säuren (z. B. Zitronensäure, Milchsäure) und bestimmte Aminosäuren aus, während Phytate, Oxalate, Polyphenole und hohe Mengen an Calcium die Absorption hemmen können.
Der primäre Ort der Eisenaufnahme ist der obere Dünndarm, insbesondere das Duodenum. Hier erfolgt die Resorption über spezialisierte Transporter: Nicht-Hämeisen wird über den Divalent Metal Transporter 1 (DMT1) aufgenommen, während Hämeisen über den Häm-Carrier-Protein 1 (HCP1) in die Enterozyten gelangt. Innerhalb der Darmzellen kann Eisen entweder temporär in Ferritin gespeichert oder über den einzigen bekannten zellulären Eisenausfuhrtransporter Ferroportin in das Blut abgegeben werden. Der Export von Eisen aus den Enterozyten und anderen eisenverarbeitenden Zellen wird systemisch durch das Leberhormon Hepcidin reguliert. Dieses zentrale Regulatormolekül bindet an Ferroportin, führt zu dessen Internalisierung und Abbau und senkt dadurch die Eisenfreisetzung in den Blutkreislauf. Bei hohem Eisenstatus oder inflammatorischen Reizen steigt die Hepcidinproduktion an, was zu einer verminderten Eisenverfügbarkeit führt. Umgekehrt wird bei Eisenmangel oder erhöhtem Erythropoese-Bedarf die Hepcidinsynthese gehemmt, wodurch vermehrt Eisen aus der Nahrung aufgenommen und aus den Speichern mobilisiert wird. Im Plasma wird freies Eisen nahezu vollständig an das Transportprotein Transferrin gebunden. Transferrin kann zweiwertiges Eisen in oxidierter Form (Fe³⁺) binden und transportiert es über den Blutstrom zu eisenabhängigen Geweben, insbesondere dem Knochenmark, wo es für die Hämoglobin-Synthese in der Erythropoese benötigt wird. Zellen nehmen Eisen durch Transferrinrezeptoren auf, die durch Endozytose ganze Transferrin-Eisen-Komplexe internalisieren. Nach Freisetzung und intrazellulärer Nutzung wird Transferrin wieder ins Blut zurückgeführt.
Die präzise Regulation des Eisenstoffwechsels ist entscheidend, da sowohl Eisenmangel als auch Eisenüberladung schwerwiegende Folgen haben können. Eisenmangel beeinträchtigt die Hämoglobinsynthese und führt langfristig zu Anämie, verminderter kognitiver Leistungsfähigkeit, geschwächter Immunabwehr und erhöhter Infektanfälligkeit. Eine Eisenüberladung hingegen kann durch verstärkte Bildung freier Radikale zu chronischen Organschäden, insbesondere in Leber, Herz und endokrinen Organen, führen. Der menschliche Organismus verfügt über keine aktive Ausscheidungsfunktion für überschüssiges Eisen, weshalb die Resorptionssteuerung über den Darm die zentrale Stellgröße im Eisenhaushalt darstellt.
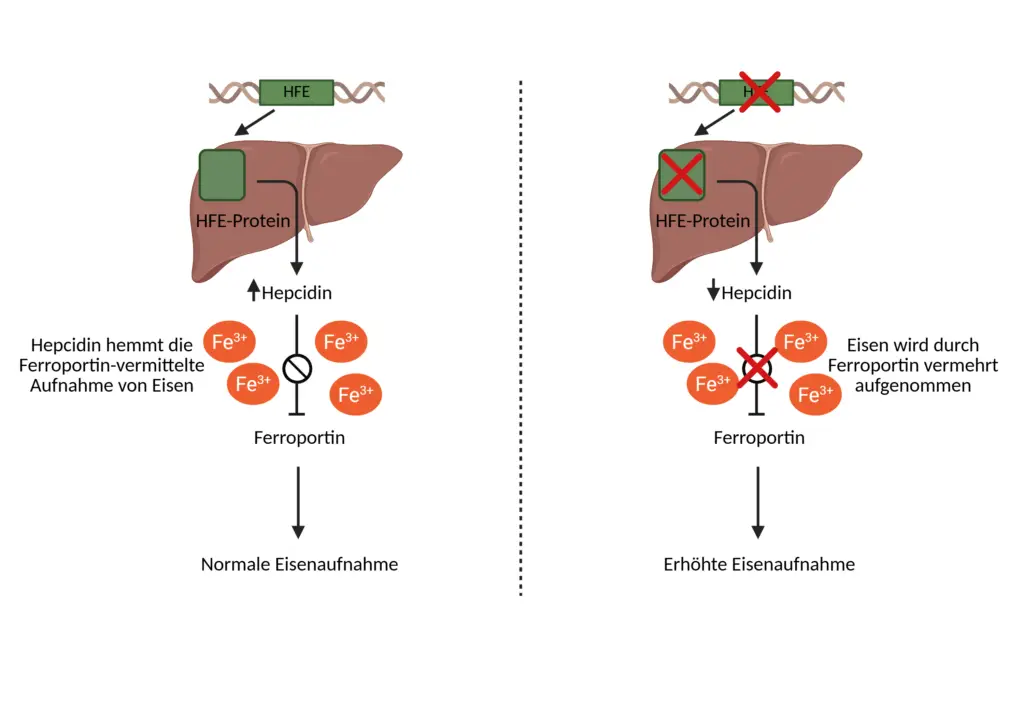
Das HFE-Gen, kurz für „High-Fe“, ist für die Synthese des gleichnamigen HFE-Proteins verantwortlich, das für eine geregelte Eisenaufnahme in unserem Körper verantwortlich ist. Das HFE-Gen befindet sich auf Chromosom 6 an der Position p22.2 (kurzer Arm des Chromosoms) und erstreckt sich über knapp 12.000 Basenpaare. Das HFE-Protein spielt eine bedeutende Rolle bei der Hepcidin-Produktion, indem es der Leber signalisiert den Hepcidin-Spiegel zu erhöhen, wenn genug Eisen im Körper ist. Hepcidin ist ein Hormon, das von der Leber produziert wird und den Eisenstoffwechsel reguliert, indem es das Protein Ferroportin hemmt. Ferroportin ermöglicht die Aufnahme von Eisen aus den Enterozyten in die Blutbahn. Wird Hepcidin ausreichend hergestellt und genügend Eisen im Körper vorhanden ist, wird die Eisenfreisetzung in die Blutbahn verhindert und die Aufnahme im Darm reduziert. Wenn das HFE-Protein nicht richtig hergestellt werden kann, wird dieser Regulationsmechanismus gestört und zu wenig Hepcidin wird hergestellt. Der niedrige Hepcidin-Spiegel führt dazu, dass zu viel Eisen aus dem Darm ins Blut gelangt, was zu einer Eisenüberladung im Körper führt. Das HFE-Protein reguliert die Eisenaufnahme durch zwei verschiedene Systeme. Das erste System befindet sich im Dünndarm, wo der Körper das erste Mal mit dem Eisen, das aus der Nahrung gewonnen wird, in Berührung kommt. Das zweite System findet in der Leber statt. Damit Eisen aus unserer Nahrung im Darm aufgenommen werden kann, muss es in eine lösliche Form gebracht werden. Dabei wird Fe3+ (dreiwertiges Eisen) aus der Nahrung mit Hilfe von Vitamin C und der Magensäure in Fe2+ (zweiwertiges Eisen) umgewandelt. Im Darm angelangt, kann das Eisen über bestimmte Transporter, wie etwa dem divalentem Metalltransporter 1 (DMT1), der in den Enterozyten des Dünndarms liegt, aufgenommen werden. Aus den Zellen wird ein gewisser Teil des Eisens in Form von Ferritin gespeichert. Ferritin ist ein Proteinkomplex, der als Speicher für freies Eisen im menschlichen Körper dient. Der restliche Teil wird durch das Protein Ferroportin von den Enterozyten ins Blut abgegeben. Ist das Eisen einmal durch den Dünndarm in die Blutkreisbahn gelangt, wird es dort an ein Molekül namens Transferrin gebunden, dass das Eisen zu den Organen und Geweben bringt, die es benötigen. Normalerweise sind nur etwa 30% aller Transferrin-Moleküle mit Eisen besetzt, bei Menschen mit einem defekten HFE-Gen sind alle Transferrin-Moleküle beladen und dadurch ist zu viel Eisen um Umlauf. Ein Großteil des Eisens wird durch Transferrin an das Knochenmark geliefert, wo es als Hämoglobinmoleküle in neu gebildete Erythrozyten (rote Blutkörperchen) eingebaut wird. Der Rest des Eisens wird an die Leber abgegeben. In der Leber spielt nun Hfe eine zweite bedeutende Rolle bei der Eisenaufnahme. Ist Hfe an den Transferrinrezeptor (TFR) gebunden, kann das Eisen nicht in die Zelle aufgenommen werden. Fehlt das HFE-Protein, wird das mit Eisen beladene Transferrin in die Zelle aufgenommen, das Eisen dissoziiert und bleibt im Zellinneren, wobei das Transferrin wieder ausgeschieden wird. Das Eisen, das von den Leberzellen nicht sofort verwendet wird, wird durch Ferritin gespeichert. Wenn der Ferritin-Speicher voll ist, kann das Eisen nicht mehr aufgenommen werden und es entfaltet seine Toxizität, indem es zu oxidativem Stress führt. Wird zu viel Eisen aufgrund eines nicht intakten HFE-Gens aufgenommen, kommt es zu einer Eisenüberladung. Dieser Zustand wird als Hämochromatose bezeichnet. Das überschüssige Eisen kann sich in Organen wie Herz, Leber und Bauchspeicheldrüse ablagern und dort durch oxidativen Stress die Zellen schädigen. Im Herzen kann eine Eisenüberladung die Herzmuskulatur schädigen, das zu Herzrhythmusstörungen führen kann. In der Leber kann eine übermäßige Eisenansammlung zu Leberzirrhose, Leberversagen bis hin zu Leberkrebs führen. Diabetes kann eine Folge durch die Eisenablagerung in er Bauchspeicheldrüse sein, da die Insulinproduktion gestört wird. Außerdem kann das Eisen nicht mehr in Form von Ferritin gespeichert werden und zirkuliert als freies Eisen in unserem Körper. Dieses freie Eisen kann mit Sauerstoff reagieren und reaktive Sauerstoffspezies bilden (ROS). ROS sind hochreaktive Moleküle, die nicht nur zu oxidativem Stress führen, sondern auch Membrane, Proteine und sogar die DNA beschädigen können.
Innerhalb der Genanalysen bei NovoMedic werden 3 verschieden Genloci untersucht, die für die Eisenaufnahme von Bedeutung sind. Der häufigste Polymorphismus des HFE-Gens, ist der rs1800562 (G/G), der am kurzen Arm von Chromosom 6 an der Position 845 liegt, und zu einem nicht funktionsfähigen Protein führt. Hierbei wird die Base Guanin durch Adenin ausgetauscht. In weiterer Folge wird dadurch das Codon verfälscht und anstatt eines Cysteins wird ein Tyrosin in die Polypeptidkette eingebaut. Dieser Polymorphismus bewirkt, dass das Protein nicht an die Zelloberfläche gelangt und somit nicht mit Hepcidin und den TFRs interagieren kann.
Beim nächsten Polymorphismus rs1799945 (C/C) wird die Base Cytosin durch Guanin ersetzt. Dieser Polymorphismus befindet sich an Position 187 von Chromosom 6 und führt dazu, dass die Aminosäure Histidin gegen Asparaginsäure ausgetauscht wird. Dies führt dazu, dass Eisen in der Leber vermehrt aufgenommen wird und akkumuliert.
Der seltenste Polymorphismus rs1800730 (A/A) liegt auf Position 193 von Chromosom 6 und hier wird die Base Adenin durch Thymin ersetzt. Auch dies führt dann zu einer Veränderung in der Aminosäuresequenz, indem Serin durch Cystein ersetzt wird. Dieser Polymorphismus stellt die harmloseste Variante der Hämochromatose dar und Menschen mit dieser Genvariation haben oft nur selten Beschwerden. All diese Polymorphismen werden autosomal-rezessiven vererbt. Das bedeutet, dass die Symptome einer Hämochromatose nur dann auftreten, wenn beide Allele eines Gens die mutierte Genvariante haben.
Eisen ist ein essenzielles Spurenelement für die Erhaltung der Blutgesundheit. Es ist ein Bestandteil des Hämoglobins und Myoglobins – Proteine, die für die Sauerstoffversorgung in unserem Körper zuständig sind. Ein Mangel an Eisen kann nicht nur zu Müdigkeit und Erschöpfung führen, häufige Mangelsymptome sind auch: Haarausfall, brüchige Nägel, Konzentrationsstörungen, Lernschwäche, Schwindel etc. Doch nicht nur ein Eisenmangel kann unseren Körper negativ beeinträchtigen, auch ein Überschuss an Eisen kann gefährlich werden. Wenn das HFE-Gen ein funktionierendes HFE-Protein erzeugen kann, wird die Eisenaufnahme innerhalb unseres Körpers strengstens reguliert. Durchschnittlich absorbiert man etwa 10% des Eisens, das durch unsere Ernährung aufgenommen wird (1-2mg). Bei Hämochromatose steigt dieser Wert auf 3-4 mg. Dadurch vermehrt sich das Gesamtkörpereisen von 4-5g auf bis zu 80g. Bereits ab 20g sind erste klinische Symptome zu beobachten. Wird die Hämochromatose nicht rechtzeitig entdeckt und behandelt, führt diese Erkrankung unweigerlich zum Tod. Kann jedoch anhand von genetischen Parametern eruiert werden, dass ein Patient ein erhöhtes Risiko hat, kann man früh genug anfangen auf seinen Eisenkonsum zu achten und somit Leberzirrhosen oder Diabetes vermeiden.
Barton, J. C. & Parker, C. J. (2024, 11. April). HFE-Related Hemochromatosis. GeneReviews® – NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK1440/Correnti, M., Gammella, E., Cairo, G., & Recalcati, S. (2024). Iron Absorption: Molecular and Pathophysiological Aspects. Metabolites, 14(4), 228. https://doi.org/10.3390/metabo14040228
Hämochromatose erbliche Krankheiten die Leber. (o. D.). https://lebertransplantation.eu/die-leber/erbliche-krankheiten/haemochromatose#:~:text=Die%20H%C3%A4mochromatose%20ist%20eine%20genetisch,H%C3%A4mochromatose
%20zu%20den%20h%C3%A4ufigsten%20Erbkrankheiten
Hämochromatose Typ 1 (HFE-Mutationen H63D, S65C, C282Y) – Medizinische Laboratorien Düsseldorf. (o. D.). Medizinische Laboratorien Düsseldorf. https://www.labor-duesseldorf.de/examination/view/haemochromatose-typ-1-hfe-mutationen-h63d-s65c-c282y
Katsarou, M., Papasavva, M., Latsi, R. & Drakoulis, N. (2019). Hemochromatosis: Hereditary hemochromatosis and HFE gene. Vitamins And Hormones, 201–222. https://doi.org/10.1016/bs.vh.2019.01.010
Katsarou, M., Latsi, R., Papasavva, M., Demertzis, N., Kalogridis, T., Tsatsakis, A.M. … Drakoulis, N. (2016). Population-based analysis of the frequency of HFE gene polymorphisms: Correlation with the susceptibility to develop hereditary hemochromatosis. Molecular Medicine Reports, 14, 630-636. https://doi.org/10.3892/mmr.2016.5317
Katsarou, M.-S., Papasavva, M., Latsi, R., & Drakoulis, N. (2019). Chapter Ten – Hemochromatosis: Hereditary hemochromatosis and HFE gene. In G. Litwack (Ed.), Vitamins and hormones (Vol. 110, pp. 201–222). Academic Press. https://doi.org/10.1016/bs.vh.2019.01.010
Katsarou, Martha & Papasavva, Maria & Latsi, Rozana & Drakoulis, Nikolaos. (2019). Hemochromatosis: Hereditary hemochromatosis and HFE gene. 10.1016/bs.vh.2019.01.010.
Lian, J., Xu, L., Huang, Y., Le, Y., Jiang, D., Yang, X., Xu, W., Huang, X., Dong, C., Ye, M., Zhou, J., & Duan, S. (2013). Meta-analyses of HFE variants in coronary heart disease. Gene, 527(1), 167–173. https://doi.org/10.1016/j.gene.2013.06.034
Przybyszewska, J., & Żekanowska, E. (2014). The role of hepcidin, ferroportin, HCP1, and DMT1 protein in iron absorption in the human digestive tract. Gastroenterology Review/Przegląd Gastroenterologiczny, 9(4), 208-213. https://doi.org/10.5114/pg.2014.45102
Rolić, T., Yazdani, M., Mandić, S. et al. Iron Metabolism, Calcium, Magnesium and Trace Elements: A Review. Biol Trace Elem Res 203, 2216–2225 (2025). https://doi.org/10.1007/s12011-024-04289-z
Theil E. C. (2011). Iron homeostasis and nutritional iron deficiency. The Journal of nutrition, 141(4), 724S–728S. https://doi.org/10.3945/jn.110.127639
West, A. R., & Oates, P. S. (2008). Mechanisms of heme iron absorption: current questions and controversies. World journal of gastroenterology, 14(26), 4101–4110. https://doi.org/10.3748/wjg.14.4101
Yanatori I., Kishi F., (2018) DMT1 and iron transport. Free Radical Biology and Medicine
Volume 133, March 2019, Pages 55-63. https://doi.org/10.1016/j.freeradbiomed.2018.07.020