Lesedauer: 12 Minuten

Lesedauer: 12 Minuten

Laktose fördert im Dünndarm die Resorption von Kalzium – einem Mineral, das überwiegend in Knochengewebe eingebaut, aber auch für neuromuskuläre, hormonelle und hämostatische Prozesse benötigt wird. Der Abbau von Laktose ist abhängig von der Aktivität des Enzyms Laktase, das durch das LCT-Gen codiert wird. Eine verminderte oder ausbleibende Laktaseexpression im Erwachsenenalter – genetisch als Laktase-Nichtpersistenz definiert – führt zur eingeschränkten Laktoseverwertung und hat damit potenziell negative Auswirkungen auf die Kalziumbilanz. Der folgende Beitrag beleuchtet die physiologischen, molekulargenetischen und klinischen Zusammenhänge dieser Wechselwirkung – mit besonderem Fokus auf die Relevanz für die ärztliche Praxis.
Calcium ist für Knochen, Zähne, Nervenleitung und Blutgerinnung unentbehrlich. Die intestinale Aufnahme hängt stark vom Vitamin-D-Status und von der Löslichkeit des Minerals im Darm ab – hier spielt Laktose eine entscheidende Rolle, da sie Calcium im Darmlumen löslich hält und dessen Resorption unterstützt.
Das LCT-Gen codiert das Enzym Laktase, das für die Spaltung von Laktose in Glukose und Galaktose verantwortlich ist. Bei der Genvariante G/G (rs4988235) wird zu wenig Laktase produziert, wodurch ungespaltene Laktose fermentiert wird – typische Symptome wie Blähungen, Durchfall oder Bauchschmerzen entstehen.
Betroffene verzichten häufig auf Milchprodukte – die Hauptquelle für gut verfügbares Calcium. Das kann zu einem langfristigen Calciumdefizit führen mit erhöhtem Risiko für Osteopenie, Osteoporose, Muskelkrämpfe oder Herzrhythmusstörungen.
Für die medizinische Praxis ist wichtig, dass Patient:innen mit LCT-rs4988235-G/G-Genotyp bei Laktoseintoleranz auf calciumreiche Alternativen (z. B. grüne Blattgemüse, Nüsse, Hülsenfrüchte) oder gezielte Nahrungsergänzung zurückgreifen. Eine regelmäßige Kontrolle der Calciumwerte (halbjährlich bis jährlich) sowie eine ausreichende Vitamin-D-Versorgung sind essenziell zur Sicherung der Calciumverwertung.
Kalzium (Ca²⁺) ist ein zweiwertiges Kation mit herausragender systemischer Relevanz für nahezu alle Gewebearten des menschlichen Körpers. Als quantitativ bedeutsamstes Mineral liegt es im menschlichen Organismus in einer Gesamtmenge von etwa 1–1,5 kg vor. Der überwiegende Anteil ist in Form von Hydroxylapatitkristallen im Knochengewebe gespeichert, wo Kalzium gemeinsam mit Phosphat die strukturelle Stabilität und mechanische Belastbarkeit des Skeletts gewährleistet. Der restliche Teil des Kalziums befindet sich im Blutplasma sowie in der intra- und extrazellulären Flüssigkeit, wo das Ion in freier oder proteingebundener Form eine Vielzahl kritischer physiologischer Funktionen übernimmt. Diese nicht-strukturellen Funktionen umfassen unter anderem die elektromechanische Kopplung in Muskelzellen (einschließlich Myokard), die synaptische Reizweiterleitung im zentralen und peripheren Nervensystem, die Aktivierung gerinnungsrelevanter Proteine (z. B. Prothrombin), die Regulation hormoneller Sekretion (z. B. Insulin) sowie die intrazelluläre Signaltransduktion als universeller Second Messenger in nahezu allen Zelltypen. Aufgrund dieser zentralen Aufgaben ist der menschliche Organismus auf eine stabile Kalziumhomöostase angewiesen. Diese wird über ein komplexes hormonelles Regelwerk unter Kontrolle gehalten, in dem Parathormon (PTH), Calcitriol (aktive Form von Vitamin D₃) und Calcitonin antagonistisch regulierend eingreifen.
Im Zentrum dieser Regulation steht die intestinale Kalziumresorption. Die Effektivität dieser Resorptionsmechanismen ist abhängig von mehreren Einflussfaktoren: dem Vitamin-D-Status, der Kalziumkonzentration im Darmlumen, dem pH-Wert sowie der Anwesenheit von Begleitstoffen, die die Löslichkeit und Bioverfügbarkeit des Kalziums modulieren. Eine dieser Substanzen ist Laktose, der in Milch und Milchprodukten enthaltene Disaccharid-Zucker, bestehend aus Glukose und Galaktose. Laktose wirkt auf mehreren Ebenen kalziumfördernd: Zum einen stabilisiert sie die Kalziumionen im Darmlumen in löslicher Form, wodurch die Resorptionsrate gesteigert wird; zum anderen stimuliert sie über ihren osmotischen Effekt die Permeabilität der Darmzotten. Entscheidend für diesen Effekt ist jedoch die enzymatische Spaltung von Laktose, ein Prozess, der durch das Enzym Laktase-Phlorizin-Hydrolase vermittelt wird. Dieses wird im apikalen Bürstensaum der Enterozyten exprimiert und durch das LCT- kodiert.
Die Expression des LCT-Gens ist entwicklungsgeschichtlich auf den Säuglingszeitraum fokussiert, in dem Milch die primäre Nahrungsquelle darstellt. Bei vielen Menschen kommt es nach dem Abstillen zu einer physiologischen Reduktion der Laktaseaktivität. Ein Phänomen, das als Laktase-Nichtpersistenz bezeichnet wird. Ist die Laktaseaktivität im Erwachsenenalter vermindert oder vollständig erloschen, kann Laktose im Dünndarm nicht mehr adäquat gespalten werden. Die unverdauten Disaccharide gelangen in den Dickdarm, wo sie durch bakterielle Fermentation in kurzkettige Fettsäuren und Gase umgewandelt werden. Die Folge sind gastrointestinale Symptome wie Flatulenz, abdominelle Schmerzen, Diarrhö und Völlegefühl, klinisch als Laktoseintoleranz bekannt.
Aus ernährungsphysiologischer Sicht ergibt sich hier ein kritischer Zielkonflikt: Um Beschwerden zu vermeiden, verzichten viele Betroffene auf laktosehaltige Lebensmittel, darunter auch Milchprodukte, die in der westlichen Ernährung die wichtigsten Kalziumquellen darstellen. Die Folge ist eine signifikant reduzierte Kalziumzufuhr, die, sofern unbehandelt, zu funktionellen Mangelerscheinungen und strukturellen Schäden führt. Hierzu zählen eine verringerte Knochendichte (Osteopenie), manifestierte Osteoporose, neuromuskuläre Übererregbarkeit (Tetanie, Muskelkrämpfe), kardiovaskuläre Rhythmusstörungen, Störungen der Blutgerinnung sowie ein erhöhtes Frakturrisiko im Alter.
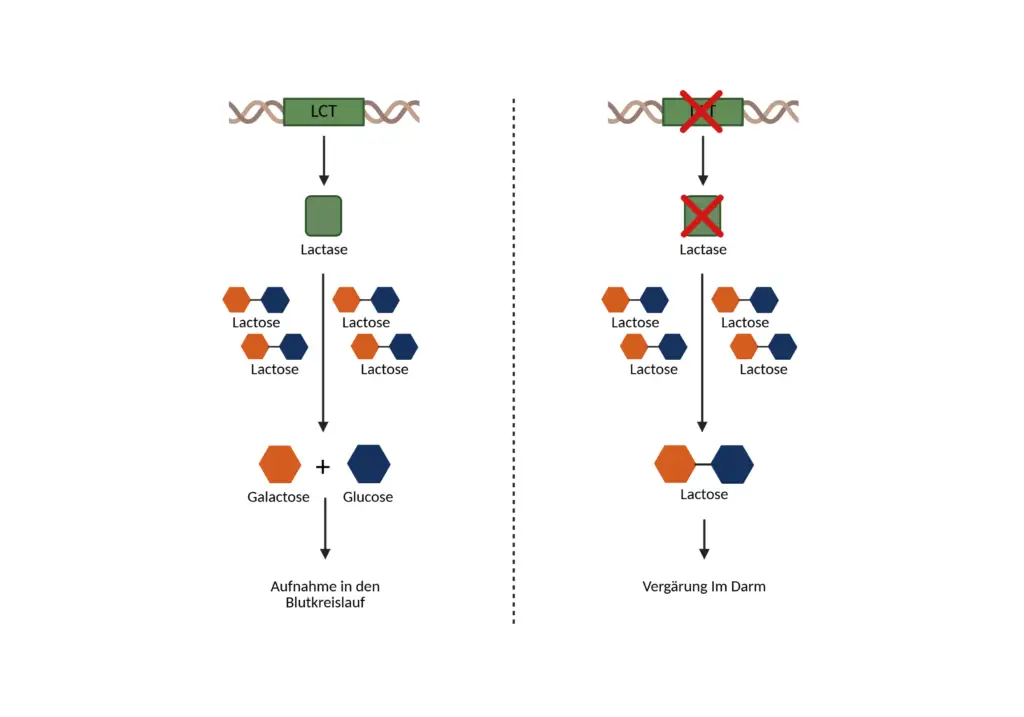
Das LCT-Gen, auch bekannt als Laktase-Gen, kodiert für das Enzym Laktase-Phlorizin-Hydrolase, das im menschlichen Dünndarm für die hydrolytische Spaltung von Laktose, dem Hauptzucker der Milch, in die resorbierbaren Monosaccharide Glukose und Galaktose verantwortlich ist. Diese enzymatische Reaktion ist essenziell für die intestinale Aufnahme von Milchzucker und hat darüber hinaus eine sekundäre Bedeutung für die Bioverfügbarkeit von Kalzium. Das Gen befindet sich auf Chromosom 2 am Locus q21 (langer Arm des Chromosoms) und erstreckt sich über knapp 50.000 Basenpaare. Die Laktase selbst wird in den Enterozyten des Dünndarms gebildet und an deren Bürstensaummembran lokalisiert, wo sie unmittelbar nach der Synthese in Kontakt mit dem Darmlumen tritt und ihre Funktion ausübt. Die Laktase katalysiert die hydrolytische Spaltung des Disaccharids Laktose, das aus einem Molekül β-D-Galaktose und einem Molekül β-D-Glukose besteht, welche über eine β-1,4-glykosidische Bindung miteinander verknüpft sind. Die enzymatische Spaltung erfolgt in einem zweistufigen Mechanismus im Bürstensaum des oberen Teils des Dünndarms: Zunächst bindet das Laktosemolekül spezifisch an das aktive Zentrum der Laktase. Dieses Zentrum enthält eine katalytisch aktive Carboxylgruppe (typischerweise Aspartat oder Glutamat), die als Nukleophil fungiert. Die Carboxylgruppe greift das anomere Kohlenstoffatom der Galaktoseeinheit an und destabilisiert dadurch die β-1,4-glykosidische Bindung. Durch die Anlagerung eines Wassermoleküls wird die Bindung gespalten, wobei ein Molekül D-Glukose und ein Molekül D-Galaktose freigesetzt werden. Beide Zucker sind nun in freier Form vorliegend und können aktiv (über SGLT1) oder passiv (über GLUT2) in die Enterozyten aufgenommen und dem systemischen Stoffwechsel zugeführt werden. Diese biochemische Reaktion ist hochspezifisch und erfolgt unter physiologischen Bedingungen mit optimaler Aktivität bei einem leicht sauren bis neutralen pH-Wert (pH ~6). Die katalytische Effizienz ist insbesondere im Säuglingsalter hoch, da Milch in dieser Phase die primäre Energie- und Kalziumquelle darstellt. Mit zunehmendem Alter kommt es bei einem Großteil der Weltbevölkerung jedoch zu einer transkriptionsbedingten Reduktion der Laktaseaktivität, ein Prozess, der als Laktase-Nichtpersistenz bezeichnet wird.
Fehlt die funktionelle Laktase, verbleibt die Laktose ungespalten im Dünndarm und wird in den Dickdarm weitergeleitet, wo sie durch anaerobe Darmbakterien fermentiert wird. Dabei entstehen Gase (Wasserstoff, Methan, CO₂) sowie osmotisch aktive Metabolite (z. B. kurzkettige Fettsäuren), die osmotisch Wasser ins Darmlumen ziehen und die intestinale Motilität steigern. Klinisch äußert sich dies in typischen Symptomen wie Blähungen, Diarrhö, abdominellen Schmerzen und teilweise Übelkeit, zusammengefasst als Laktoseintoleranz. Diese enzymatisch bedingte Einschränkung hat nicht nur Auswirkungen auf den Kohlenhydratstoffwechsel, sondern auch auf die Mineralstoffbilanz, insbesondere die Kalziumaufnahme. Laktose wirkt im Darmlumen nämlich als Kalziumlösungsvermittler: Sie verhindert die Bildung unlöslicher Kalziumsalze und verbessert so die Verfügbarkeit für den aktiven Transport durch enterale Kalziumkanäle. Ein Ausfall dieses Mechanismus führt häufig zu einer langfristigen Reduktion der Kalziumresorption, da betroffene Personen Milchprodukte meiden.
Eine gewisse Menge an Laktase ist bei vielen Menschen im Kindesalter vorhanden, da es für die Verdauung der Muttermilch notwendig ist. Üblicherweise nimmt die Laktase-Produktion im Alter ab, aber bei einem großen Anteil der Bevölkerung wird weiterhin ausreichend Laktase produziert, um Milchprodukte ein Leben lang problemlos konsumieren zu können. Innerhalb der Genanalysen von NovoMedic kann durch Bestimmung des LCT-Genotyps (AA, AG, oder GG) die genetische Veranlagung des Patienten für Laktose Intoleranz untersucht werden. Bei der Genvariante A/A, die 32% der Bevölkerung tragen, reden wir von einem SNP (Single Nucleotid Polymorphismus) bei dem Laktase ausreichend produziert werden kann und damit auch Milchprodukte konsumiert werden können. Daraus schließt sich auch, dass Milchprodukte eine gute Einnahmequelle für Calcium darstellen. Ebenfalls ausreichend Laktase kann von der Genvariante A/G produziert werden, die zu 37% in unserer Bevölkerung vertreten ist. Genetische Analysen haben ergeben, dass Laktosetoleranz im Erwachsenenalter als autosomal dominantes Merkmal vererbt wird. Das bedeutet, dass nur ein funktionierendes Allel (beim LCT-Gen A) vorhanden sein muss, um die nötige Funktion vollkommen zu übernehmen. Bei der Genvariante G/G kann hingegen nicht genug Laktase produziert werden. Die betroffenen Menschen, die 31% unserer Bevölkerung ausmachen, sind Laktose intolerant und müssen sich eine andere Quelle für die Calciumzufuhr aussuchen.
Mit einer Veränderung im LCT-Gen ist man nicht nur eingeschränkt Milchprodukte zu genießen, sondern man verliert auch gleichzeitig den wertvollsten Calciumlieferanten aus unserer Ernährung. Diverse Käsesorten, sowie Kuh- und Ziegenmilch sind nämlich dafür bekannt, dass sie eine hohe Konzentration an Calcium beinhalten, die unser Körper über den Darm in den Blutkreislauf aufnehmen kann. Wenn das Calcium einmal im Blut aufgenommen ist, wird es durch den Körper transportiert und in die Knochen integriert. Doch Calcium spielt nicht nur eine essenzielle Rolle für unsere Knochen, es ist auch wichtig für unsere Zähne, die Übertragung von Nervensignalen und die Blutgerinnung. Niedrige Calciumspiegel können auch bereits im subklinischen Bereich unangenehme Befindlichkeitsstörungen, wie trockene, schuppige Haut, brüchige Nägel und strohiges Haar verursachen und in fortgeschrittenerem Stadium zu Muskelkrämpfen, Verwirrtheit, Gedächtnisverlust, Delir, Depressionen und Halluzinationen, sowie Krampfanfällen und Herzrhythmusstörungen führen. Es ist daher ganz entscheidend Risikogruppen frühzeitig zu identifizieren und einer entsprechend engeren Kontrolle der Calciumwerte zu unterziehen – eine Genanalyse kann dabei helfen. Jenen 31% Ihrer Patientengruppe, die statistisch betrachtet aufgrund des ungünstigen Genotyps G/G im LCT-Gen (rs4988285) Laktose tendenziell schlechter vertragen, ist folgende Vorgehensweise anzuraten: Bis erste Beschwerden auftreten können Milchprodukte weiterhin konsumiert werden. Werden jedoch erste Beschwerden bemerkt, sollte der Konsum von Milchprodukten reduziert und andere Kalziumquellen, wie Spinat, Grünkohl, Rucola und Linsen oder gezielte Nahrungsergänzung, bevorzugt werden. Außerdem ist spätestens ab diesem Zeitpunkt eine regelmäßige (6- bis 12-monatliche) Kontrolle der Calciumwerte anzuraten.
Anguita-Ruiz, A., Aguilera, C. M., & Gil, Á. (2020). Genetics of Lactose Intolerance: An Updated Review and Online Interactive World Maps of Phenotype and Genotype Frequencies. Nutrients, 12(9), 2689. https://doi.org/10.3390/nu12092689
Anguita Ruiz, Augusto & Aguilera, Concepción & Gil, Ángel. (2020). Genetics of Lactose Intolerance: An Updated Review and Online Interactive World Maps of Phenotype and Genotype Frequencies. Nutrients. 12. 10.3390/nu12092689.
Chin, E. L., Huang, L., Bouzid, Y. Y., Kirschke, C. P., Durbin-Johnson, B., Baldiviez, L. M., Bonnel, E. L., Keim, N. L., Korf, I., Stephensen, C. B., & Lemay, D. G. (2019). Association of Lactase Persistence Genotypes (rs4988235) and Ethnicity with Dairy Intake in a Healthy U.S. Population. Nutrients, 11(8), 1860. https://doi.org/10.3390/nu11081860
Cochet, B., Jung, A., Griessen, M., Bartholdi, P., Schaller, P., & Donath, A. (1983). Effects of lactose on intestinal calcium absorption in normal and lactase-deficient subjects. Gastroenterology, 84(5 Pt 1), 935–940.
D’Alessandro, A., & De Pergola, G. (2015). Mediterranean Diet and Cardiovascular Disease: A Critical Evaluation of A Priori Dietary Indexes. Nutrients, 7(9), 7863–7888. https://doi.org/10.3390/nu7095367
Hodges, J. K., Cao, S., Cladis, D. P. & Weaver, C. M. (2019). Lactose Intolerance and Bone Health: The Challenge of Ensuring Adequate Calcium Intake. Nutrients, 11(4), 718. https://doi.org/10.3390/nu11040718
Ilesanmi-Oyelere, B. L. & Kruger, M. C. (2020). The Role of Milk Components, Pro-, Pre-, and Synbiotic Foods in Calcium Absorption and Bone Health Maintenance. Frontiers in Nutrition, 7. https://doi.org/10.3389/fnut.2020.578702
National Library of Medicine. (o. D.). Lactose intolerance. MedlinePlus. https://medlineplus.gov/lactoseintolerance.html
Obermayer-Pietsch, B. M., Bonelli, C. M., Walter, D. E., Kuhn, R. J., Fahrleitner-Pammer, A., Berghold, A., Goessler, W., Stepan, V., Dobnig, H., Leb, G., & Renner, W. (2004). Genetic predisposition for adult lactose intolerance and relation to diet, bone density, and bone fractures. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research, 19(1), 42–47. https://doi.org/10.1359/JBMR.0301207
Office of Dietary Supplements – Calcium. (o. D.). https://ods.od.nih.gov/factsheets/Calcium-HealthProfessional/
Poulter, M., Hollox, E., Harvey, C. B., Mulcare, C., Peuhkuri, K., Kajander, K., Sarner, M., Korpela, R. & Swallow, D. M. (2003). The Causal Element for the Lactase Persistence/ non‐persistence Polymorphism is Located in a 1 Mb Region of Linkage Disequilibrium in Europeans. Annals Of Human Genetics, 67(4), 298–311. https://doi.org/10.1046/j.1469-1809.2003.00048.x
Schuette, S. A., Knowles, J. B. & Ford, H. E. (1989). Effect of lactose or its component sugars on jejunal calcium absorption in adult man. American Journal Of Clinical Nutrition, 50(5), 1084–1087. https://doi.org/10.1093/ajcn/50.5.1084
SNP Highlight – Lactose Intolerance & MCM6. (o. D.). https://www.toolboxgenomics.com/blog/snp-highlight-lactose-intolerance-mcm6/
Weiskirchen, R., Tag, C. G., Mengsteab, S., Gressner, A. M., Ingram, C. J. & Swallow, D. M. (2007). Pitfalls in LightCycler diagnosis of the single-nucleotide polymorphism 13.9 kb upstream of the lactase gene that is associated with adult-type hypolactasia. Clinica Chimica Acta, 384(1–2), 93–98. https://doi.org/10.1016/j.cca.2007.06.008
Wikipedia contributors. (2025, 4. Mai). Lactase. Wikipedia. https://en.wikipedia.org/wiki/Lactase