Lesedauer: 27 Minuten
Lesedauer: 27 Minuten
Die Verarbeitung toxischer Substanzen aus Rauch, Asche und verbrannten Lebensmitteln stellt hohe Anforderungen an das körpereigene Entgiftungssystem – insbesondere bei Belastung mit polyzyklischen aromatischen Kohlenwasserstoffen (PAKs). Entscheidend dafür ist die Aktivität von Phase-I-Enzymen wie CYP1A1 und CYP1B1, deren Effizienz stark durch genetische Polymorphismen beeinflusst wird. In diesem Beitrag beleuchten wir die molekularen Mechanismen hinter der PAK-Verstoffwechslung und zeigen auf, wie sich genetische Schwächen gezielt durch Ernährung, Mikronährstoffe und Lebensstilinterventionen kompensieren lassen.
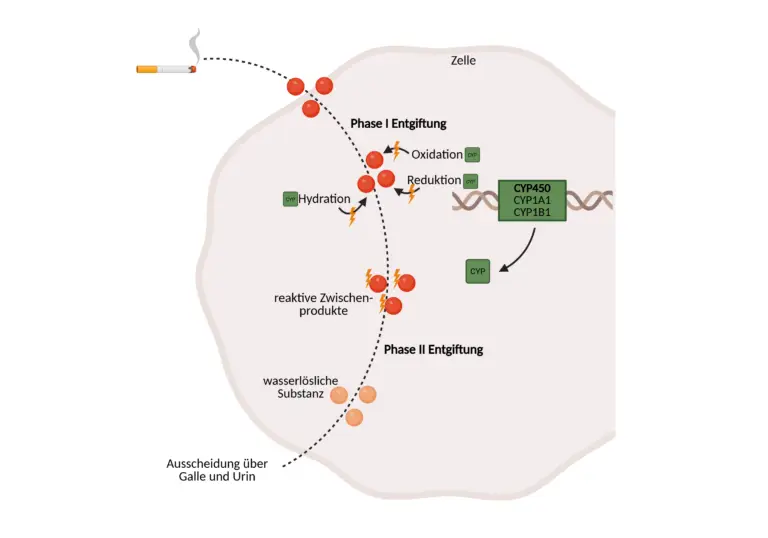
Beim Konsum stark erhitzter oder verbrannter Lebensmittel (z. B. Grillfleisch, geröstetes Brot) gelangen polyzyklische aromatische Kohlenwasserstoffe (PAKs) und heterozyklische aromatische Amine (HAKs) in den Körper – fettlösliche Schadstoffe, die nur über komplexe Entgiftungsschritte ausgeleitet werden können.
In Phase I der Entgiftung werden diese Substanzen durch CYP450-Enzyme (v. a. CYP1A1 und CYP1B1) aktiviert. Dabei entstehen oft reaktive Zwischenprodukte (z. B. Epoxide), die DNA schädigen können. Die Phase II (z. B. über GST, UGT, SULT) macht diese Metabolite wasserlöslich und ausscheidbar – ein kritisches Gleichgewicht ist entscheidend.
Genetische Varianten in CYP1A1, CYP1B1 oder in Phase-II-Enzymen können die Entgiftungskapazität deutlich verringern. Die Folge: längere Verweildauer toxischer Stoffe, erhöhter oxidativer Stress, entzündliche Reaktionen und ein gesteigertes Risiko für Tumorerkrankungen – besonders bei häufiger Belastung durch Grillen, Rauchen oder Luftschadstoffe.
Für die medizinische Praxis ist wichtig, dass bei genetischer Entgiftungsschwäche verbrannte Nahrungsmittel gemieden und gleichzeitig antioxidative Schutzmechanismen gezielt gestärkt werden – durch sekundäre Pflanzenstoffe (z. B. Sulforaphan), Mikronährstoffe (Vitamin C, E, Selen, NAC) und einen aktiven Lebensstil.
Wenn wir verbrannte oder stark erhitzte Nahrungsmittel zu uns nehmen, beispielsweise gegrilltes Fleisch, angebratene Wurst oder sogar stark gerösteten Toast, gelangen lipophile Schadstoffe wie polyzyklische aromatische Kohlenwasserstoffe (PAKs) und heterozyklische aromatische Amine (HAKs) in unseren Körper. Diese Verbindungen sind chemisch stabil, fettlöslich und lassen sich nicht einfach über Urin oder Galle ausscheiden. Um sie dennoch entgiften zu können, hat der menschliche Organismus ein ausgeklügeltes, zweistufiges System entwickelt: die Biotransformation, bestehend aus Phase I und Phase II. Im Zentrum der ersten Phase steht eine Enzymfamilie, die eine Schlüsselrolle bei der Entgiftung einnimmt: die Cytochrom-P450-Familie (CYP450).
Cytochrom-P450-Enzyme sind Häm-haltige Monooxygenasen, die überwiegend in der Leber, aber auch in Geweben wie Darm, Lunge, Haut oder Brustdrüse vorkommen. Sie sitzen in der Membran des glatten endoplasmatischen Retikulums und katalysieren biochemische Reaktionen, bei denen ein Sauerstoffmolekül gespalten wird: Ein Sauerstoffatom wird auf das lipophile Substrat übertragen (z. B. ein verbranntes Nahrungsbestandteil), das andere zu Wasser reduziert. Diese sogenannte Monooxygenierung verändert die Struktur des Moleküls, typischerweise durch Hydroxylierung, Epoxidierung, Desalkylierung oder Deaminierung , wodurch das Substrat chemisch reaktiver und etwas polarer wird. Ziel ist es, das Molekül auf die anschließende Phase II vorzubereiten, in der es endgültig ausscheidbar gemacht wird.
Diese Aktivierung hat jedoch auch eine Kehrseite. Denn bei der Verstoffwechslung von PAKs und HAKs entstehen durch CYP450-Reaktionen oft nicht harmlose Zwischenprodukte, sondern besonders reaktive Metabolite, etwa Epoxide oder Chinone, die mit zellulären Strukturen reagieren können. Diese Substanzen sind elektrophil, binden bevorzugt an die N7-Position von Guaninbasen und bilden sogenannte DNA-Addukte, die zu Mutationen führen können. Ein klassisches Beispiel ist Benzopyren, ein PAK, das bei der Verbrennung organischer Materialien entsteht (z. B. in Zigarettenrauch oder Grillgut). In mehreren CYP-katalysierten Schritten entsteht daraus das hochreaktive Benzopyren-7,8-diol-9,10-epoxid, das in vitro und in vivo eine stark mutagene Wirkung zeigt.
Die Phase-I-Enzyme, insbesondere Vertreter der CYP1-, CYP2- und CYP3-Familien, wirken also wie eine Art biochemischer „Feuerwehr“: Sie erkennen körperfremde, lipophile Substanzen und verändern sie so, dass sie weiterverarbeitet werden können. Doch die „Aktivierung“ ist nur der erste Schritt, die eigentliche Entgiftung geschieht in der Phase II. Hier binden spezialisierte Enzyme wie Glutathion-S-Transferasen (GST), UDP-Glucuronosyltransferasen (UGT), Sulfotransferasen (SULT) oder N-Acetyltransferasen (NAT) hydrophile Gruppen an die reaktiven Zentren der Phase-I-Zwischenprodukte. Erst durch diese Konjugationsreaktionen werden die Moleküle endgültig wasserlöslich und können über Galle oder Niere ausgeschieden werden. Entscheidend ist dabei das Gleichgewicht zwischen Phase I und Phase II. Ist Phase I besonders aktiv, etwa durch genetische Polymorphismen oder die Induktion durch Umweltstoffe und Phase II nicht entsprechend leistungsfähig, kommt es zu einem metabolischen Kurzschluss. Reaktive Metabolite reichern sich an, verursachen oxidativen Stress, fördern entzündliche Prozesse und können das Risiko für chronische erhöhen. Dieses Ungleichgewicht kann durch genetische Varianten, Mikronährstoffmängel oder übermäßige Belastung durch Umweltgifte entstehen.
Die Cytochrom-P450-Familie selbst umfasst beim Menschen über 50 funktionelle Enzyme, die in mehreren Familien zusammengefasst sind. Neben ihrer Rolle im Abbau körperfremder Stoffe (Xenobiotika) sind sie auch am Metabolismus körpereigener Substanzen beteiligt, etwa an der Synthese und dem Abbau von Steroidhormonen, Vitamin D, Gallensäuren und mehrfach ungesättigten Fettsäuren. Sie sind damit nicht nur Entgiftungshelfer, sondern auch Schlüsselakteure im hormonellen Gleichgewicht, in der Zellmembranregulation und in der Immunantwort. Interessanterweise ist die Aktivität der CYP-Enzyme individuell unterschiedlich: Genetische Polymorphismen und epigenetische Faktoren beeinflussen, wie schnell oder langsam bestimmte Substanzen abgebaut werden. Manche Menschen haben eine hohe CYP-Aktivität, wodurch sie schneller toxische Zwischenprodukte bilden, andere sind langsame Metabolisierer. Dies erklärt nicht nur individuelle Reaktionen auf Medikamente oder Umweltstoffe, sondern auch das unterschiedliche Risiko für durch Umweltgifte mitverursachte Erkrankungen.
Insgesamt gesehen ist die Cytochrom-P450-Familie ein zentrales Schaltorgan des biochemischen Entgiftungssystems. Ihre Fähigkeit, fettlösliche Schadstoffe in reaktive, weiterverarbeitbare Metabolite zu überführen, ist essenziell für unsere tägliche Auseinandersetzung mit Umweltgiften, insbesondere jenen, die durch verbrannte oder stark erhitzte Lebensmittel entstehen. Um diese Prozesse sicher und effizient ablaufen zu lassen, ist es jedoch entscheidend, dass auch die nachgelagerte Phase II sowie die antioxidative Schutzmechanismen ausreichend funktionieren. Nur so kann der Körper langfristig vor Zellschäden und chronischen Erkrankungen geschützt werden.
Das CYP1A1-Gen (Cytochrom P450, Familie 1, Subfamilie A, Polypeptid 1) kodiert für ein Enzym aus der Cytochrom-P450-Superfamilie, das eine zentrale Rolle in der Biotransformation lipophiler, potenziell toxischer Substanzen spielt, insbesondere bei der Entgiftung von polyzyklischen aromatischen Kohlenwasserstoffen (PAKs), wie sie beim Grillen, Braten oder bei der Verbrennung organischer Materie entstehen. Das Gen ist auf Chromosom 15 an der Position q24.1 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 5.800 Basenpaare. Das von CYP1A1 gebildete Enzym ist eine sogenannte Monooxygenase und wird hauptsächlich in der Leber, aber auch in Lunge, Darm und weiteren Geweben gebildet und ist dort in die Membran des glatten endoplasmatischen Retikulums integriert. Es ist und dort an einem hochkomplexen Reaktionsmechanismus beteiligt, der es dem Körper ermöglicht, schwer wasserlösliche Umweltgifte chemisch zu aktivieren und für die weitere Entgiftung vorzubereiten.
Biochemisch betrachtet besteht die zentrale Funktion von CYP1A1 darin, ein Sauerstoffmolekül (O₂) zu spalten und ein Sauerstoffatom auf das lipophile Substrat, beispielsweise Benzo[a]pyren, zu übertragen, während das zweite Sauerstoffatom zu Wasser reduziert wird. Diese Reaktion ist energieabhängig und erfordert Elektronen, die über NADPH bereitgestellt werden. Dabei durchläuft das im aktiven Zentrum des Enzyms befindliche Eisenion des Häm-Rings mehrere Redoxzustände: Im ersten Schritt wird das Eisen von Fe³⁺ auf Fe²⁺ reduziert, um molekularen Sauerstoff binden zu können. Anschließend wird dieser Sauerstoff durch einen zweiten Elektronentransfer aktiviert, sodass ein hochreaktiver Sauerstoffkomplex entsteht. Dieser ermöglicht die Übertragung eines Sauerstoffatoms auf das Substrat, meist in Form einer Hydroxylgruppe (–OH) oder durch Bildung eines Epoxidrings. Gleichzeitig wird das zweite Sauerstoffatom zu Wasser reduziert und der Zyklus beginnt von vorn. Diese enzymatische Aktivierung ist ein notwendiger erster Schritt in der Entgiftung, hat jedoch eine ambivalente Wirkung: Denn die durch CYP1A1 gebildeten Zwischenprodukte sind keineswegs harmlos – im Gegenteil. Vor allem bei aromatischen Verbindungen wie PAKs entstehen durch diese Reaktion elektrophile Metabolite wie Epoxide oder Chinone, die eine hohe Affinität zu Nukleinsäuren besitzen und leicht mit DNA-Basen reagieren können. Solche Reaktionen führen zur Bildung stabiler DNA-Addukte, die die Replikation und Transkription stören und langfristig zu Mutationen führen können. Besonders bekannt ist in diesem Zusammenhang das Benzo[a]pyren-7,8-diol-9,10-epoxid, ein hochreaktives Zwischenprodukt, das in mehreren CYP1A1-vermittelten Schritten aus Benzo[a]pyren entsteht und als einer der stärksten mutagenen Substanzen überhaupt gilt. Es bindet bevorzugt an die N7-Position von Guanin und wird in vielen Tumorzellen von Rauchern und Personen mit hoher Grillfleischaufnahme nachgewiesen.
Die Aktivität von CYP1A1 wird durch den Aryl-Hydrocarbon-Rezeptor (AhR) reguliert, der nach Kontakt mit bestimmten Umweltchemikalien, wie Benzo[a]pyren, aktiviert wird. Nach Bindung an den Liganden transloziert der AhR in den Zellkern, wo er die Transkription von CYP1A1 steigert. Dieser Mechanismus ermöglicht eine schnelle und lokal angepasste Reaktion auf toxische Belastungen, birgt jedoch auch Risiken, wenn die nachgeschalteten Schutzmechanismen, insbesondere die Phase-II-Konjugationssysteme, nicht ausreichend funktionieren. Denn die durch CYP1A1 aktivierten Substanzen sind nur dann wirklich entgiftbar, wenn sie in einem zweiten Schritt durch Phase-II-Enzyme wie Glutathion-S-Transferasen (GST), UDP-Glucuronosyltransferasen (UGT) oder Sulfotransferasen (SULT) konjugiert werden. Erst durch die Anlagerung hydrophiler Gruppen wie Glutathion oder Glucuronsäure können diese reaktiven Zwischenprodukte neutralisiert und über Galle oder Niere ausgeschieden werden. Ist diese zweite Phase jedoch genetisch eingeschränkt, durch Mikronährstoffmangel oder oxidativen Stress überfordert, können sich die toxischen Metabolite im Gewebe anreichern, mit potenziell schädlichen Folgen für Zellen und Gewebe.
Die Reaktion von CYP1A1 steht daher exemplarisch für die „doppelte Natur“ der Phase-I-Biotransformation: Sie ermöglicht einerseits die Aktivierung schwer eliminierbarer Fremdstoffe, erhöht aber gleichzeitig die chemische Reaktivität der Substrate, eine Belastung, die vom Körper nur dann schadlos verarbeitet werden kann, wenn auch die Phase-II-Enzyme ausreichend aktiv sind.
Insgesamt ist CYP1A1 ein Schlüsselenzym in der Entgiftung von verbrannten Nahrungsbestandteilen und Umweltgiften. Seine biochemische Reaktion ist hochspezifisch, energieabhängig und funktionell eng mit antioxidativen Schutzsystemen und Konjugationsenzymen verknüpft. In der präventiven und personalisierten Medizin stellt CYP1A1 daher nicht nur einen zentralen Biomarker für Umweltbelastung dar, sondern auch einen potenziellen therapeutischen Ansatzpunkt, um Entgiftungskapazität, Mikronährstoffversorgung und Risikoprofile individuell zu analysieren und gezielt zu steuern.
Damit Schadstoffe wie polyzyklische aromatische Kohlenwasserstoffe (PAKs), die beim Grillen, Rauchen oder durch Luftverschmutzung entstehen, effizient vom Körper abgebaut werden können, braucht es ein funktionell aktives Cytochrom-P450-Enzym 1A1 (CYP1A1). Dieses Enzym wird vom gleichnamigen Gen codiert und spielt eine zentrale Rolle in der Phase-I-Entgiftung. Es katalysiert die erste biochemische Umwandlung lipophiler Umweltgifte in reaktive Zwischenprodukte, die anschließend durch Phase-II-Enzyme weiterverarbeitet und ausgeschieden werden können. Wie gut diese Entgiftung funktioniert, ist individuell unterschiedlich und wird unter anderem durch genetische Varianten im CYP1A1-Gen bestimmt, insbesondere durch die beiden Einzelnukleotid-Polymorphismen (SNPs) rs1048943 und rs4646903.
Bei rs1048943 handelt es sich um eine Punktmutation, bei der die Base Thymin (T) durch Cytosin (C) ersetzt sein kann. Diese Veränderung beeinflusst die Struktur und Aktivität des CYP1A1-Enzyms direkt. Personen mit dem Genotyp T/T, der bei etwa 77 % der Bevölkerung vorkommt, verfügen über die ursprüngliche, funktionell günstige Genvariante. In diesem Fall arbeitet das Enzym effizient, und die Entgiftung von Schadstoffen aus verbrannten Lebensmitteln, Rauch oder Ruß verläuft reibungslos. Reaktive Zwischenprodukte werden zügig gebildet und können anschließend durch Phase-II-Enzyme neutralisiert werden. Bei Trägern der heterozygoten Variante T/C oder C/T (etwa 19 % der Bevölkerung) ist eines der beiden Allele verändert, was zu einer leicht eingeschränkten Enzymaktivität führen kann. Die Umwandlung von PAKs in ausscheidbare Metabolite verläuft langsamer, wodurch diese länger im Körper verbleiben und potenziell mehr oxidative Schäden anrichten können. Besonders kritisch wird es bei Personen mit der homozygoten C/C-Variante, die in etwa 4 % der Bevölkerung vorkommt. Hier ist die Enzymaktivität deutlich reduziert, sodass toxische Stoffe aus verbranntem oder rauchbelastetem Material nur unzureichend abgebaut werden. In der Folge steigt die Belastung durch reaktive Sauerstoffspezies und DNA-schädigende Metabolite, was langfristig das Risiko für Entzündungen und umweltbedingte Erkrankungen erhöhen kann.
Der zweite relevante Polymorphismus, rs4646903, befindet sich in der regulatorischen Region des CYP1A1-Gens und beeinflusst, wie stark das Gen exprimiert wird, also wie viel Enzym tatsächlich gebildet wird. Auch hier gibt es drei mögliche Genvarianten: Die A/A-Variante, die bei rund 52 % der Menschen auftritt, ist mit einer normalen Expression und damit mit einer effektiven Entgiftungsleistung verbunden. Bei diesem Genotyp wird ausreichend CYP1A1 produziert, sodass der Körper in der Lage ist, PAKs schnell zu aktivieren und weiterzuleiten. Anders verhält es sich bei der heterozygoten A/G oder G/A-Variante, die etwa 37 % der Bevölkerung betrifft. Hier ist die Genaktivität leicht reduziert, was zu einer geringeren Enzymmenge und damit zu einer verlangsamten Entgiftung führen kann. Am stärksten betroffen sind Personen mit dem G/G-Genotyp, der bei rund 11 % der Bevölkerung vorliegt. Bei ihnen ist die Expression des CYP1A1-Gens deutlich vermindert, sodass nur wenig Enzym gebildet wird. Dies führt zu einer eingeschränkten Entgiftungskapazität und einer erhöhten Anfälligkeit für toxische Belastungen.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung dieser beiden Genvarianten eine individuelle Risikoeinschätzung vorgenommen werden. Menschen mit mindestens einer Risikovariante, also T/C oder C/C bei rs1048943 bzw. A/G oder G/G bei rs4646903, profitieren besonders von gezielten präventiven Maßnahmen. Dazu gehören der bewusste Verzicht auf stark verbrannte oder rauchbelastete Nahrungsmittel, eine ausreichende Versorgung mit antioxidativen Mikronährstoffen wie Vitamin C, Selen oder Glutathion sowie die gezielte Unterstützung der Phase-II-Entgiftung durch sekundäre Pflanzenstoffe wie Sulforaphan aus Brokkoli. Auf diese Weise kann die Entgiftungsleistung optimiert, die zelluläre Belastung reduziert und das Risiko für langfristige Schäden durch Umweltgifte deutlich verringert werden.
Das CYP1B1-Gen (Cytochrom P450, Familie 1, Subfamilie B, Polypeptid 1) kodiert für ein Enzym aus der Cytochrom-P450-Superfamilie, das eine zentrale Rolle in der Biotransformation lipophiler, potenziell toxischer Substanzen spielt. Besonders bedeutsam ist seine Funktion bei der Entgiftung von polyzyklischen aromatischen Kohlenwasserstoffen (PAKs), wie sie bei der Verbrennung organischer Materialien, dem Grillen, Braten oder beim Tabakrauchen entstehen. Das Gen ist auf dem langen Arm von Chromosom 2 (p22.2) lokalisiert und umfasst etwa 12.000 Basenpaare. Das von CYP1B1 codierte Enzym ist, ebenso wie CYP1A1, eine Monooxygenase, die vor allem in extrahepatischem Gewebe exprimiert wird, insbesondere in der Brustdrüse, Prostata, Nebenniere, Retina und im ZNS, aber auch in der Lunge und im Darm. Dort ist es in die Membran des glatten endoplasmatischen Retikulums integriert und übernimmt eine wichtige Rolle bei der lokalen Aktivierung von Umweltgiften sowie bei der Modifikation körpereigener Substanzen wie Östrogenen.
Die zentrale biochemische Funktion von CYP1B1 besteht, analog zu anderen Cytochrom-P450-Enzymen, in der Spaltung eines Sauerstoffmoleküls (O₂) und der Übertragung eines Sauerstoffatoms auf ein lipophiles Substrat, während das zweite zu Wasser reduziert wird. Diese Monooxygenierungsreaktion erfordert Elektronen, die über NADPH bereitgestellt werden. Dabei durchläuft das Eisenion des Häm-Rings mehrere Redoxzustände: Es wird zunächst von Fe³⁺ auf Fe²⁺ reduziert, um Sauerstoff binden zu können. Nach Aktivierung des gebundenen Sauerstoffs durch einen weiteren Elektronentransfer entsteht ein hochreaktiver Sauerstoffkomplex, der es ermöglicht, ein Sauerstoffatom auf das Substrat zu übertragen. Dadurch werden PAKs und andere Schadstoffe chemisch reaktiviert, was sie für die nachfolgende Phase-II-Entgiftung zugänglich macht. Die von CYP1B1 produzierten Metabolite sind allerdings keineswegs harmlos: Bei der Verstoffwechslung von PAKs entstehen häufig elektrophile Zwischenprodukte wie Dihydrodiol-Epoxide und Chinone, die stark DNA-reaktiv sind. Sie können stabile DNA-Addukte bilden, was zu Mutationen, chromosomaler Instabilität und im weiteren Verlauf zu onkogenen Prozessen führen kann. Besonders relevant ist CYP1B1 dabei im Bereich hormonell aktiver Gewebe, da es neben Xenobiotika auch 17β-Estradiol metabolisiert. Hierbei entsteht unter anderem 4-Hydroxyestradiol, ein Metabolit mit hohem oxidativem Potenzial, der in der Brustdrüse mit der Entstehung hormonabhängiger Tumoren assoziiert wird.
Die Expression von CYP1B1 wird, ähnlich wie bei CYP1A1, durch den Aryl-Hydrocarbon-Rezeptor (AhR) reguliert. Bei Kontakt mit Umweltchemikalien wie Benzo[a]pyren wird AhR aktiviert, transloziert in den Zellkern und fördert dort die Transkription von CYP1B1. Dies ermöglicht eine rasche Anpassung an toxische Belastungen, birgt aber auch Risiken: Insbesondere bei wiederholter oder chronischer Exposition gegenüber verbrannten Lebensmitteln, Tabakrauch oder Luftschadstoffen kann eine Überaktivierung von CYP1B1 zu einer massiven Bildung reaktiver Metabolite führen. Sind gleichzeitig die nachgeschalteten Phase-II-Enzyme wie Glutathion-S-Transferasen (GST), UDP-Glucuronosyltransferasen (UGT) oder Sulfotransferasen (SULT) funktionell eingeschränkt, sei es genetisch, durch Mikronährstoffmangel oder oxidativen Stress, können sich diese toxischen Metabolite im Gewebe anreichern und strukturelle Zellschäden verursachen.
Die Reaktion von CYP1B1 steht somit exemplarisch für die kritische Rolle von Phase-I-Enzymen in der Balance zwischen Entgiftung und Aktivierung. Das Enzym erweitert die chemische Reaktivität von Schadstoffen, um ihre Ausscheidung zu ermöglichen, erzeugt dabei aber auch kurzzeitig Substanzen, die mit hoher Wahrscheinlichkeit Zellstrukturen schädigen können. Diese „doppelte Natur“ erfordert eine gut abgestimmte Phase-II-Entgiftung, um potenzielle Schäden abzufangen.
In der präventiven und personalisierten Medizin kommt CYP1B1 eine besondere Bedeutung zu. Seine Expression und Aktivität variieren stark zwischen Individuen und sind durch genetische Polymorphismen sowie epigenetische Modifikationen beeinflusst. Bestimmte Genvarianten von CYP1B1 sind mit einem erhöhten Risiko für hormonabhängige Tumoren (z. B. Brustkrebs) und umweltinduzierte Karzinogenese assoziiert, insbesondere dann, wenn gleichzeitig eine hohe Exposition gegenüber Rauch, gegrilltem Fleisch oder Umweltgiften besteht. Auch für die individuelle Wirksamkeit und Verträglichkeit bestimmter Medikamente (z. B. Krebsmedikamente) spielt CYP1B1 eine Rolle.
Insgesamt ist CYP1B1 ein hochspezifisches, extrahepatisch aktives Entgiftungsenzym, das nicht nur bei der Verarbeitung exogener Karzinogene, sondern auch bei der Modifikation endogener Substanzen wie Östrogenen beteiligt ist. Die Aktivität dieses Enzyms ist eng mit der Biogenese von reaktiven Sauerstoffspezies, oxidativem Stress und hormonabhängiger Tumorbiologie verknüpft. In der personalisierten Prävention stellt CYP1B1 damit einen wertvollen Marker dar, um individuelle Umweltanfälligkeiten besser zu verstehen und gezielt über Ernährung, Lebensstil und Mikronährstoffversorgung zu regulieren.
Damit toxische Substanzen aus verbrannten oder rauchbelasteten Quellen wie Asche, Ruß oder gegrilltem Fleisch effizient im Körper abgebaut und ausgeschieden werden können, braucht es ein funktionell aktives Cytochrom P450 1B1-Enzym, codiert durch das CYP1B1-Gen. Dieses Enzym gehört zur Phase-I-Entgiftung und ist insbesondere in extrahepatischen Geweben wie Lunge, Brustdrüse oder Darm aktiv. Eine zentrale Rolle spielt dabei der genetische Abschnitt rs1056836, bei dem es zu einem Basenaustausch von Guanin (G) zu Cytosin (C) kommen kann. Diese Punktmutation verändert die Enzymstruktur geringfügig, beeinflusst aber spürbar dessen Aktivität im Umgang mit Umweltgiften, insbesondere mit polyzyklischen aromatischen Kohlenwasserstoffen (PAKs).
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung des CYP1B1-Genotyps die individuelle Entgiftungsfähigkeit im Umgang mit Rauch-, Asche- und Rußbestandteilen zuverlässig erfasst werden. Die Genvariante G/G, die bei rund 46 % der Bevölkerung vorkommt, stellt die ursprüngliche, funktionell günstige Form des Gens dar. In diesem Fall zeigt das CYP1B1-Enzym eine effektive enzymatische Aktivität. Reaktive Zwischenprodukte aus PAKs, die beim Einatmen oder beim Konsum von verbrannten Nahrungsmitteln entstehen, werden zuverlässig biochemisch aktiviert und stehen der anschließenden Konjugation in Phase II rasch zur Verfügung. Dadurch wird die Belastung durch potenziell mutagene oder oxidative Stoffwechselprodukte minimiert. Beim heterozygoten Genotyp G/C oder C/G, der bei etwa 31 % der Bevölkerung auftritt, ist eines der beiden Allele verändert. Dies kann zu einer reduzierten Enzymaktivität führen. In der Folge ist die Aktivierung toxischer Substanzen weniger effizient, wodurch sie länger im Körper verbleiben oder unvollständig entgiftet werden. Besonders bei regelmäßiger Exposition gegenüber Rauch oder verbranntem Essen kann sich dies negativ auf die zelluläre Belastung auswirken, vor allem, wenn zusätzlich die Phase-II-Entgiftungskapazität genetisch oder ernährungsbedingt eingeschränkt ist. Die homozygote Risikovariante C/C, die bei rund 23 % der Bevölkerung vorkommt, ist mit einer deutlich verringerten CYP1B1-Aktivität assoziiert. In diesem Fall ist die Fähigkeit des Körpers, PAKs und verwandte Schadstoffe biochemisch zu verarbeiten, erheblich eingeschränkt. Toxische Verbindungen bleiben länger im Gewebe aktiv, was zu einer erhöhten Bildung von DNA-Addukten, oxidativem Stress und potenziell entzündlichen oder karzinogenen Folgeprozessen führen kann. Betroffene Personen zeigen eine gesteigerte Empfindlichkeit gegenüber Umweltgiften und profitieren besonders von gezielten präventiven Maßnahmen wie dem Meiden verbrannter Speisen und dem gezielten Einsatz von antioxidativen Mikronährstoffen.
Die effiziente Entgiftung von Schadstoffen aus verbrannten Materialien, etwa Asche, Rauch oder stark erhitzten Lebensmitteln, ist essenziell für die Erhaltung der Zellgesundheit und zur Vorbeugung chronischer Erkrankungen. Besonders problematisch sind polyzyklische aromatische Kohlenwasserstoffe (PAKs), die bei der Verbrennung organischer Substanzen entstehen und über Nahrung oder Atemluft in den Körper gelangen. Genetische Varianten in Entgiftungsgenen wie CYP1A1 und CYP1B1 beeinflussen, wie gut der Körper mit diesen Schadstoffen umgehen kann. Bei entsprechender genetischer Veranlagung ist die Aktivierung oder Weiterverarbeitung dieser Substanzen verlangsamt, reaktive Zwischenprodukte bleiben länger im Organismus, was das Risiko für oxidativen Stress, DNA-Schäden und entzündliche Prozesse erhöht. In solchen Fällen gewinnen gezielte präventive Maßnahmen stark an Bedeutung.
Besonders empfehlenswert ist eine antioxidativ orientierte, pflanzenbasierte Ernährung. Viel frisches Gemüse, Beeren, Kräuter, Nüsse und grüne Blattgemüse liefern natürliche Schutzstoffe gegen freie Radikale. Sekundäre Pflanzenstoffe wie Sulforaphan (z. B. aus Brokkoli), Curcumin (aus Kurkuma), Resveratrol (aus roten Trauben) oder OPC (aus Traubenkernen) können die Phase-II-Entgiftung gezielt unterstützen und dabei helfen, reaktive Metabolite unschädlich zu machen. Gleichzeitig sollte die Zufuhr von stark erhitzten, verkohlten oder rauchbelasteten Lebensmitteln möglichst reduziert werden. Das gilt insbesondere für geräuchertes Fleisch, Grillgut, verbranntes Fett oder stark geröstete Getreideprodukte.
Auch Mikronährstoffe spielen eine zentrale Rolle in der körpereigenen Entgiftung: Vitamin C, Vitamin E, Zink, Selen, Glutathion, N-Acetylcystein (NAC) und aktive B-Vitamine (insbesondere B2, B6, B12 und Folsäure) unterstützen antioxidative Enzymsysteme und sorgen dafür, dass toxische Zwischenprodukte effizient weiterverarbeitet und ausgeschieden werden. Omega-3-Fettsäuren aus Fisch oder Algen wirken zusätzlich entzündungshemmend und stabilisieren die Zellmembranen.
Ebenso bedeutend ist ein aktiver Lebensstil: Regelmäßige Bewegung, insbesondere Ausdauertraining, Intervalltraining und moderate Krafteinheiten, kann den zellulären Stoffwechsel anregen, die Leberdurchblutung verbessern und die Effizienz der Entgiftungsenzyme steigern. Schwitzen über Sport oder Saunagänge kann zudem zur Ausleitung bestimmter lipophiler Schadstoffe beitragen. Auch gezielte Essenspausen, etwa in Form von Intervallfasten, entlasten den Organismus, fördern die Autophagie und verbessern die zelluläre Regeneration.
Berlin-Potsdam, I. F. M. D. (o. D.). 200 Genetik der Entgiftung. https://www.imd-berlin.de/fachinformationen/diagnostikinformationen/genetik-der-entgiftung#:~:text=In%20der%20Phase%20I%20werden,der%20Phase%20II%20essentiell%20ist
Paracelsus Gesundheitsakademien. (o. D.). Die drei Phasen der Entgiftung – Ausgabe 2/2021 – Paracelsus Magazin. Paracelsus. https://www.paracelsus.de/magazin/ausgabe/202102/die-drei-phasen-der-entgiftung
Phase I and Phase II Xenobiotic-Metabolizing Enzymes: Structure, Function, and Regulation. (o. D.). https://www.mdpi.com/topics/BMI6Y85191?utm_source=chatgpt.com
Androutsopoulos, V. P., Tsatsakis, A. M., & Spandidos, D. A. (2009). Cytochrome P450 CYP1A1: wider roles in cancer progression and prevention. BMC cancer, 9, 187. https://doi.org/10.1186/1471-2407-9-187
Croom, E. (2012). Xenobiotic. In Progress in Molecular Biology and Translational Science (Vol. 112, pp. 1–19). Elsevier. https://doi.org/10.1016/B978-0-12-415813-9.00001-1
CYP1A1 cytochrome P450 family 1 subfamily A member 1 [Homo sapiens (human)] – Gene – NCBI. (o. D.). https://www.ncbi.nlm.nih.gov/gene/1543
DocCheck, M. B. (o. D.-a). Cytochrom P450 – DocCheck Flexikon. DocCheck Flexikon. https://flexikon.doccheck.com/de/Cytochrom_P450
Eskandari, M., Awsat Mellati, A., Mahmoodi, K., Kamali, K., & Soltanpour, M. S. (2021). Association of the CYP1A1 rs4646903 polymorphism with susceptibility and severity of coronary artery disease. Molecular biology research communications, 10(2), 22–61. https://doi.org/10.22099/mbrc.2021.39141.1574
Gilani B, Cassagnol M. Biochemistry, Cytochrome P450. [Updated 2023 Apr 24]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557698/
Iacopetta, D., Ceramella, J., Catalano, A., Scali, E., Scumaci, D., Pellegrino, M., Aquaro, S., Saturnino, C., & Sinicropi, M. S. (2023). Impact of Cytochrome P450 Enzymes on the Phase I Metabolism of Drugs. Applied Sciences, 13(10), 6045. https://doi.org/10.3390/app13106045
PharmaWiki – Cytochrome P450 (CYP). (o. D.). https://www.pharmawiki.ch/wiki/index.php?wiki=CYP
Shiizaki, K., Kawanishi, M., & Yagi, T. (2017). Modulation of benzo[a]pyrene-DNA adduct formation by CYP1 inducer and inhibitor. Genes and environment : the official journal of the Japanese Environmental Mutagen Society, 39, 14. https://doi.org/10.1186/s41021-017-0076-x
rs1048943 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1048943
rs4646903 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs4646903
Zöllner, A., Buchheit, D., Meyer, M. R., Maurer, H. H., Peters, F. T., & Bureik, M. (2010). Production of human phase 1 and 2 metabolites by whole-cell biotransformation with recombinant microbes. Bioanalysis, 2(7), 1277–1290. https://doi.org/10.4155/bio.10.80
Manikandan, P., & Nagini, S. (2018). Cytochrome P450 Structure, Function and Clinical Significance: A Review. Current drug targets, 19(1), 38–54. https://doi.org/10.2174/1389450118666170125144557
rs1056836 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1056836
Trubicka, J., Grabowska-Kłujszo, E., Suchy, J., Masojć, B., Serrano-Fernandez, P., Kurzawski, G., Cybulski, C., Górski, B., Huzarski, T., Byrski, T., Gronwald, J., Złowocka, E., Kładny, J., Banaszkiewicz, Z., Wiśniowski, R., Kowalska, E., Lubinski, J., & Scott, R. J. (2010). Variant alleles of the CYP1B1 gene are associated with colorectal cancer susceptibility. BMC cancer, 10, 420. https://doi.org/10.1186/1471-2407-10-420
Zanger, U. M., & Schwab, M. (2013). Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacology & therapeutics, 138(1), 103–141. https://doi.org/10.1016/j.pharmthera.2012.12.007
Zhao, M., Ma, J., Li, M., Zhang, Y., Jiang, B., Zhao, X., Huai, C., Shen, L., Zhang, N., He, L., & Qin, S. (2021). Cytochrome P450 Enzymes and Drug Metabolism in Humans. International journal of molecular sciences, 22(23), 12808. https://doi.org/10.3390/ijms222312808