Lesedauer: 26 Minuten

Entgiftungsfähigkeit von Phase 2
Lesedauer: 26 Minuten
Die Fähigkeit des Körpers, Umweltgifte, Medikamente und oxidative Zwischenprodukte effizient zu entgiften, beruht auf einem komplexen, zweistufigen enzymatischen System – maßgeblich beeinflusst durch genetische Faktoren. Besonders die Aktivität der Glutathion-S-Transferasen (GST), codiert durch GSTM1, GSTT1 und GSTP1, entscheidet über die Effektivität der Phase-II-Detoxifikation. In diesem Beitrag erläutern wir die molekularbiologischen Mechanismen der Entgiftung und zeigen auf, welche klinischen Konsequenzen sich aus genetisch bedingten Schwächen im GST-System ergeben.
Der menschliche Körper entgiftet chemische Substanzen in zwei Phasen: Phase I (Aktivierung, z. B. durch CYP450-Enzyme) erzeugt oft reaktive Zwischenprodukte, die erst durch Phase II (Konjugation mit Glutathion, Sulfat etc.) unschädlich gemacht und ausgeschieden werden können. Besonders kritisch ist dabei die Glutathion-S-Transferase-Familie (GSTs).
Die Enzyme GSTP1, GSTM1 und GSTT1 sind entscheidend für die Glutathion-Konjugation toxischer Stoffe. Genetische Varianten wie GSTP1 rs1695, GSTM1- oder GSTT1-Deletion können die Entgiftungsleistung erheblich verringern – mit erhöhtem Risiko für oxidativen Stress, Entzündungen und toxische Zellschäden.
Betroffene Personen reagieren oft sensibler auf Medikamente, Umweltchemikalien oder Schadstoffe wie Tabakrauch. Eine eingeschränkte GST-Aktivität kann die Anfälligkeit für chronisch-entzündliche Erkrankungen, neurodegenerative Prozesse und Tumorerkrankungen erhöhen.
Für die medizinische Praxis ist wichtig, dass bei genetisch eingeschränkter Entgiftungsleistung gezielt unterstützt wird – etwa durch N-Acetylcystein (NAC), Vitamin C, Selen, Alpha-Liponsäure, schwefelhaltiges Gemüse (z. B. Brokkoli) und Expositionsvermeidung. Eine genetische Analyse der GST-Gene hilft, Risiken frühzeitig zu erkennen und personalisiert gegenzusteuern.
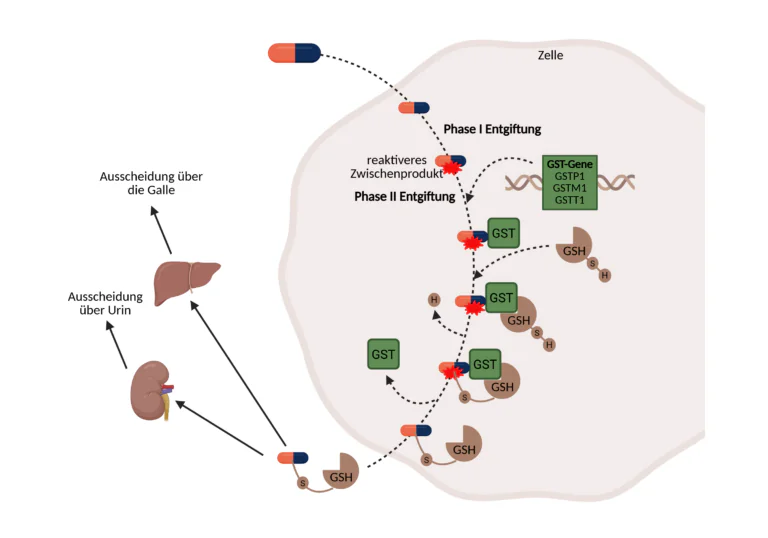
Der menschliche Organismus verfügt über ein ausgeklügeltes, mehrstufiges Entgiftungssystem, das täglich dabei hilft, eine Vielzahl potenziell schädlicher Substanzen aus dem Körper zu eliminieren. Diese Substanzen, sogenannte Xenobiotika, umfassen eine breite Palette exogener Stoffe, darunter Umweltgifte, Pestizide, Lösungsmittel, Schwermetalle, Medikamentenrückstände sowie zahlreiche chemische Verbindungen, die über Nahrung, Luft oder Haut aufgenommen werden. Viele dieser Stoffe sind in ihrer ursprünglichen Form fettlöslich (lipophil) und würden sich, unbehandelt, in Zellmembranen und Fettgewebe anreichern, dort oxidativen Stress verursachen und langfristig zu zellulären Schäden führen. Um dem entgegenzuwirken, hat der Körper ein zweistufiges Entgiftungssystem entwickelt, bestehend aus Phase I (Funktionalisierung) und Phase II (Konjugation).
In Phase I erfolgt zunächst die chemische Aktivierung der aufgenommenen Substanzen. Diese Reaktionen werden hauptsächlich durch Enzyme der Cytochrom-P450-Familie (CYPs) katalysiert, die vor allem in der Leber, aber auch in anderen stoffwechselaktiven Organen exprimiert werden. Ziel dieser Phase ist es, durch Oxidation, Reduktion oder Hydrolyse neue funktionelle Gruppen, meist Hydroxyl-, Amino- oder Carboxylgruppen in das Molekül einzuführen. Dies erhöht seine Reaktivität und Wasserlöslichkeit und schafft die Voraussetzung für die nachfolgende Phase II. Ein klassisches Beispiel ist die Hydroxylierung lipophiler aromatischer Verbindungen zu phenolischen Derivaten. Allerdings entstehen in Phase I häufig instabile reaktive Zwischenprodukte, wie Epoxide, Chinone oder freie Radikale. Diese Metaboliten sind in vielen Fällen toxischer als die Ausgangssubstanz, da sie eine hohe Affinität zur DNA, zu Proteinen und zu Zellmembranen aufweisen. Sie können kovalente Bindungen mit Zellstrukturen eingehen, Mutationen auslösen und zelluläre Funktionen stören. Der Körper ist deshalb dringend darauf angewiesen, diese Zwischenprodukte schnell weiterzuverarbeiten.
Die Phase II dient der gezielten Neutralisierung und Ausscheidung dieser reaktiven Metaboliten. In dieser Phase werden die zuvor aktivierten oder reaktiven Moleküle durch Konjugationsreaktionen an hydrophile, körpereigene Substanzen gekoppelt. Diese Kopplung erhöht die Wasserlöslichkeit der Stoffe drastisch und ermöglicht deren Ausscheidung über die Nieren (Urin) oder die Leber (Galle). Zu den wichtigsten Konjugationsreaktionen gehören die Glucuronidierung, Sulfatierung, Acetylierung, Methylierung sowie die Glutathion-Konjugation. Die Glutathion-Konjugation ist hierbei von besonderer Bedeutung für den Schutz vor oxidativem und chemischem Stress. Sie wird durch die Enzymfamilie der Glutathion-S-Transferasen (GSTs) katalysiert. Diese Enzyme ermöglichen die nukleophile Addition des reduzierten Glutathions (GSH) an elektrophile Zentren reaktiver Moleküle. Das zentrale Reaktionsprinzip besteht darin, dass die Thiolgruppe (-SH) des Cysteins im Glutathion das elektrophile Zentrum des Toxins angreift, wodurch ein kovalenter, stabiler Glutathion-Konjugatkomplex entsteht. Diese Reaktion entschärft gefährliche Substanzen wie Epoxide, Halogenverbindungen oder Lipidperoxidationsprodukte und schützt somit DNA, Proteine und Zellmembranen vor Angriffen. Glutathion selbst ist dabei nicht nur Konjugationspartner, sondern fungiert auch als zentrales redoxaktives Molekül, das die intrazelluläre Balance zwischen oxidierten und reduzierten Zuständen aufrechterhält. Der Glutathionpool muss dabei kontinuierlich durch die Aktivität der Glutathion-Reduktase regeneriert werden, um eine effektive Entgiftungskapazität zu gewährleisten. Eine Erschöpfung des Glutathionpools, etwa bei starker Umweltbelastung, Medikamentenüberdosierung oder genetischer Schwächung der GST-Enzyme, kann die Entgiftungsleistung erheblich beeinträchtigen.
Die Effizienz dieser beiden Phasen ist für die körpereigene Abwehr gegen Umweltgifte und toxische Stoffwechselprodukte von zentraler Bedeutung. Sie entscheidet darüber, wie gut der Organismus chemische Belastungen bewältigt und welche langfristigen Folgen diese auf die Zellgesundheit, Immunfunktion und metabolische Regulation haben. Bereits geringe Störungen in einem dieser Prozesse, sei es durch externe Belastungen oder genetische Varianten, können die Balance empfindlich stören und zur Entstehung chronischer Erkrankungen beitragen. Die genetisch codierten Enzyme der Glutathion-S-Transferase-Familie, insbesondere jene, die durch GSTM1, GSTT1 und GSTP1 reguliert werden, sind hier von besonderer Bedeutung, da sie eine Schlüsselrolle bei der Glutathion-basierten Konjugation spielen. Ihre Aktivität bestimmt, wie effektiv toxische Zwischenprodukte in Phase II entschärft und ausgeschieden werden können. Da diese Enzyme jeweils unterschiedliche Substratgruppen abdecken, arbeiten sie funktionell ergänzend. Ein Ausfall oder eine Abschwächung in einem Bereich kann daher nicht vollständig kompensiert werden.
Ein detailliertes Verständnis dieser biochemischen Zusammenhänge ist nicht nur für toxikologische Bewertungen und pharmakologische Dosierungen relevant, sondern bildet auch die Grundlage für moderne Präventionsstrategien. Durch gezielte Analysen der Entgiftungskapazität, etwa über genetische Tests oder funktionelle Laborparameter, lassen sich individuelle Schwächen identifizieren und durch Lebensstilmaßnahmen sowie gezielte Mikronährstofftherapien wirksam unterstützen.
Das GSTP1-Gen (Glutathion-S-Transferase Pi 1) kodiert für das gleichnamige Enzym GSTP1, das eine zentrale Rolle in der zellulären Entgiftung von chemischen Substanzen und in der Aufrechterhaltung der redoxbasierten Zellhomöostase spielt. Das Gen ist auf Chromosom 11 an der Position q13 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 3.200 Basenpaare. Das von GSTP1 exprimierte Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs), einer Gruppe von Phase-II-Enzymen, die für die Konjugation des Tripeptids Glutathion (GSH) mit einer Vielzahl an elektrophilen und potenziell toxischen Substraten verantwortlich sind. GSTP1 wird in vielen Geweben exprimiert, mit besonders hoher Aktivität in Leber, Lunge, Prostata, Niere und Gehirn, und ist vorwiegend im Zytosol lokalisiert. Im Zentrum der durch GSTP1 vermittelten Entgiftung steht die nukleophile Konjugation von GSH an elektrophile Xenobiotika, wie sie typischerweise durch Phase-I-Enzyme wie die Cytochrome P450 entstehen. Diese Substrate umfassen reaktive Epoxide, Chinone, organische Peroxide, Halogenverbindungen und Lipidperoxidationsprodukte. Die Konjugation mit Glutathion neutralisiert deren Reaktivität, erhöht die Wasserlöslichkeit und ermöglicht die nachfolgende renale oder biliäre Ausscheidung. GSTP1 wirkt dabei nicht als Substrat-spezifisches Enzym im klassischen Sinne, sondern als breit wirkender Katalysator, der über die Struktur seiner aktiven Bindungstasche eine Vielzahl molekularer Toxinstrukturen binden und entschärfen kann. Ein zentrales Merkmal der GSTP1-Funktion besteht in der selektiven Modulation zellulärer Stressreaktionen durch Entgiftung von ROS-generierenden Verbindungen und der Kontrolle intrazellulärer Signalkaskaden. GSTP1 interagiert auf posttranslationaler Ebene mit JNK (c-Jun N-terminal kinase), einem zentralen Regulator der zellulären Stressantwort, und hemmt dessen Aktivierung durch direkte Bindung. Dies verleiht dem Enzym nicht nur eine entgiftende, sondern auch eine entzündungs- und apoptosemodulierende Funktion, die in der Tumorbiologie und Präventivmedizin zunehmend an Bedeutung gewinnt. GSTP1 beeinflusst die Entgiftung chemischer Substanzen jedoch nicht isoliert, sondern im funktionellen Zusammenspiel mit anderen Glutathion-S-Transferasen wie GSTM1 und GSTT1. GSTP1 zeichnet sich durch eine hohe Affinität zu oxidierten endogenen Metaboliten und bestimmten Arzneistoffen aus, darunter Alkylanzien wie Cyclophosphamid oder Cisplatin. Durch seine ubiquitäre Expression und die strukturelle Flexibilität seines aktiven Zentrums wirkt GSTP1 als funktioneller Schlüsselregulator der zellulären Glutathion-basierten Entgiftungskapazität. Eine gestörte GSTP1-Funktion, sei es durch genetische Varianten, epigenetische Veränderungen oder Erschöpfung des Glutathionpools, kann die Effizienz der chemischen Entgiftung maßgeblich beeinträchtigen. In der Folge kommt es zur Anhäufung reaktiver Substanzen im Gewebe, zur Dysregulation von Stressantwort-Signalwegen und zu einer Erhöhung des systemischen oxidativen Stresses. Die präzise Funktion von GSTP1 ist daher essenziell für die zelluläre Detoxifikation, die Redox-Homöostase und die inflammatorische Balance und stellt einen hochrelevanten Angriffspunkt für präventive, diagnostische und therapeutische Ansätze in der personalisierten Medizin dar.
Damit chemische Schadstoffe im Körper effizient entgiftet und ausgeschieden werden können, braucht es ein funktionell aktives Enzym Glutathion-S-Transferase Pi 1 (GSTP1) – und damit ein intaktes GSTP1-Gen. Eine zentrale Rolle spielt hierbei der genetische Abschnitt rs1695, bei dem es zu einem Austausch der Base Guanin (G) durch Adenin (A) kommen kann. Diese Punktmutation beeinflusst die Struktur des aktiven Zentrums des Enzyms und verändert dessen Fähigkeit, toxische Substanzen mit Glutathion zu konjugieren und somit unschädlich zu machen. Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung des GSTP1-Genotyps die individuelle genetische Veranlagung zur chemischen Entgiftung analysiert werden. Der Genotyp G/G, der bei etwa 14 % der Bevölkerung vorkommt, entspricht der Variante mit der höchsten enzymatischen Aktivität. In diesem Fall ist die Glutathion-S-Transferase Pi 1 in ihrer funktionell effizientesten Form aktiv. Die Bindung an reaktive Toxine erfolgt optimal, die Konjugation mit Glutathion ist hochwirksam, und die Ausscheidung potenziell schädlicher Substanzen kann effizient erfolgen. Personen mit diesem Genotyp verfügen über eine hohe Entgiftungskapazität, insbesondere gegenüber Umweltgiften, Medikamentenmetaboliten und oxidativem Stress. Der heterozygote Genotyp G/A oder A/G, der bei rund 43 % der Bevölkerung vorliegt, führt zu einer gemischten Expression beider Varianten. Zwar ist ein funktionelles Allel vorhanden, doch die veränderte Struktur des zweiten Allels (mit Adenin an Position 1695) kann zu einer leicht reduzierten Enzymaktivität führen. Insgesamt bleibt die Entgiftungsleistung bei diesem Genotyp noch weitgehend erhalten. Die Reaktionsgeschwindigkeit mit Glutathion ist leicht verringert, was bei starker Exposition gegenüber Umwelttoxinen, Medikamenten oder Alkohol zu einer erhöhten zellulären Belastung führen kann. Die homozygote A/A-Variante, die bei etwa 43 % der Bevölkerung vorkommt, ist mit einer deutlich veränderten Enzymstruktur und einer stark verminderten Entgiftungskapazität assoziiert. Die Affinität des Enzyms zu toxischen Substraten ist deutlich reduziert, die Konjugation mit Glutathion verläuft verlangsamt und weniger effizient. Infolgedessen verbleiben reaktive Zwischenprodukte länger im Zellinneren und können dort oxidativen Stress, Entzündungen oder DNA-Schäden verursachen. Personen mit diesem Genotyp haben ein erhöhtes Risiko für toxisch bedingte Folgeerkrankungen, insbesondere bei regelmäßigem Kontakt mit Umweltchemikalien, Pestiziden, Lösungsmitteln oder bei häufiger Medikamenteneinnahme. Auch die Wirksamkeit und Verträglichkeit bestimmter Medikamente kann bei diesem Genotyp stark verändert sein. Die Bestimmung des GSTP1-Genotyps (rs1695) erlaubt eine gezielte Einschätzung der individuellen Entgiftungskapazität und ist ein wichtiger Baustein in der personalisierten Präventionsmedizin. Personen mit eingeschränkter GSTP1-Aktivität können gezielt unterstützt werden, etwa durch die Zufuhr von Glutathion-Vorstufen wie N-Acetylcystein, antioxidativen Mikronährstoffen wie Vitamin C, Selen oder Alpha-Liponsäure sowie durch Maßnahmen zur Expositionsvermeidung und Stärkung des Leberstoffwechsels. Ziel ist es, die körpereigene Detoxifikation gezielt zu fördern und langfristige Schäden durch eine unzureichende Entgiftung zu vermeiden.
Das GSTM1-Gen (Glutathion-S-Transferase Mu 1) kodiert für das gleichnamige Enzym GSTM1, das eine zentrale Rolle in der Entgiftung von Fremdstoffen und potenziell zellschädigenden Metaboliten spielt. Das Gen ist auf Chromosom 1 an der Position p13.3 (kurzer Arm des Chromosoms) lokalisiert und umfasst etwa 5.000 Basenpaare. Das von GSTM1 exprimierte Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs), einer Gruppe zytosolischer Phase-II-Enzyme, die für die Konjugation reaktiver Substanzen mit Glutathion (GSH) verantwortlich sind. GSTM1 wird primär in entgiftungsrelevanten Geweben wie Leber, Darm, Lunge und Niere exprimiert und schützt Zellen vor toxischen Einflüssen durch Umweltchemikalien, Medikamentenmetabolite und endogene Oxidationsprodukte. GSTM1 wirkt nicht direkt spaltend oder oxidierend, sondern modulierend auf die Reaktivität toxischer Substanzen. Nach der Phase-I-Transformation durch Cytochrom-P450-Enzyme entstehen häufig elektrophile Zwischenprodukte, die stark reaktiv sind und zelluläre Makromoleküle wie DNA, Proteine oder Lipide schädigen können. GSTM1 katalysiert die kovalente Kopplung dieser Zwischenprodukte an Glutathion, wodurch ihre Reaktivität neutralisiert und ihre Wasserlöslichkeit erhöht wird. Das Ergebnis ist ein stabiler GSH-Konjugat-Komplex, der über die Niere oder Galle aus dem Körper ausgeschieden werden kann. GSTM1 ist dabei insbesondere auf die Entgiftung großer aromatischer Verbindungen wie polyzyklische aromatische Kohlenwasserstoffe (PAKs), Benzopyrene oder heterozyklische Amine spezialisiert, typische Bestandteile von Tabakrauch, Industrieemissionen und gegrillten Lebensmitteln. Ein zentrales Wirkprinzip von GSTM1 besteht in der Optimierung der Entgiftungskinetik. Das Enzym beeinflusst sowohl die Geschwindigkeit als auch die Effektivität der Konjugation. In Anwesenheit eines funktionell aktiven GSTM1-Proteins erfolgt die Glutathion-Kopplung effizient, was zu einer raschen Reduktion toxischer Intermediate im Zellinneren führt. GSTM1 unterstützt dabei die intrazelluläre „Entgiftungskaskade“, stabilisiert das Redoxgleichgewicht und verhindert die Akkumulation von ROS (reaktive Sauerstoffspezies) und anderen radikalischen Substanzen. Die Detoxifikationsrate steigt messbar an, wodurch die Zelle schneller und effektiver gegen externe Belastungen geschützt ist. Darüber hinaus trägt GSTM1 zur Gewebespezifität der Entgiftung bei: In der Lunge ist es besonders wichtig zur Neutralisierung inhalierter Schadstoffe, während es in der Leber zur Phase-II-Verarbeitung von Arzneimittelmetaboliten beiträgt. GSTM1 agiert somit nicht statisch, sondern dynamisch, abhängig von Umweltfaktoren, Ernährung, Medikamenteneinnahme und dem allgemeinen Stoffwechselzustand. Bei erhöhter Toxinexposition, etwa durch Rauchen, Luftverschmutzung oder bestimmten Berufsrisiken, ist eine hohe GSTM1-Aktivität entscheidend, um eine übermäßige oxidative Belastung und zelluläre Schädigung zu verhindern.
Das GSTM1-Gen (Glutathion-S-Transferase Mu 1) kodiert für das gleichnamige Enzym GSTM1, das eine zentrale Rolle in der Entgiftung von Fremdstoffen und potenziell zellschädigenden Metaboliten spielt. Das Gen ist auf Chromosom 1 an der Position p13.3 (kurzer Arm des Chromosoms) lokalisiert und umfasst etwa 5.000 Basenpaare. Das von GSTM1 exprimierte Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs), einer Gruppe zytosolischer Phase-II-Enzyme, die für die Konjugation reaktiver Substanzen mit Glutathion (GSH) verantwortlich sind. GSTM1 wird primär in entgiftungsrelevanten Geweben wie Leber, Darm, Lunge und Niere exprimiert und schützt Zellen vor toxischen Einflüssen durch Umweltchemikalien, Medikamentenmetabolite und endogene Oxidationsprodukte.
GSTM1 wirkt nicht direkt spaltend oder oxidierend, sondern modulierend auf die Reaktivität toxischer Substanzen. Nach der Phase-I-Transformation durch Cytochrom-P450-Enzyme entstehen häufig elektrophile Zwischenprodukte, die stark reaktiv sind und zelluläre Makromoleküle wie DNA, Proteine oder Lipide schädigen können. GSTM1 katalysiert die kovalente Kopplung dieser Zwischenprodukte an Glutathion, wodurch ihre Reaktivität neutralisiert und ihre Wasserlöslichkeit erhöht wird. Das Ergebnis ist ein stabiler GSH-Konjugat-Komplex, der über die Niere oder Galle aus dem Körper ausgeschieden werden kann. GSTM1 ist dabei insbesondere auf die Entgiftung großer aromatischer Verbindungen wie polyzyklische aromatische Kohlenwasserstoffe (PAKs), Benzopyrene oder heterozyklische Amine spezialisiert, typische Bestandteile von Tabakrauch, Industrieemissionen und gegrillten Lebensmitteln.
Ein zentrales Wirkprinzip von GSTM1 besteht in der Optimierung der Entgiftungskinetik. Das Enzym beeinflusst sowohl die Geschwindigkeit als auch die Effektivität der Konjugation. In Anwesenheit eines funktionell aktiven GSTM1-Proteins erfolgt die Glutathion-Kopplung effizient, was zu einer raschen Reduktion toxischer Intermediate im Zellinneren führt. GSTM1 unterstützt dabei die intrazelluläre „Entgiftungskaskade“, stabilisiert das Redoxgleichgewicht und verhindert die Akkumulation von ROS (reaktive Sauerstoffspezies) und anderen radikalischen Substanzen. Die Detoxifikationsrate steigt messbar an, wodurch die Zelle schneller und effektiver gegen externe Belastungen geschützt ist. Darüber hinaus trägt GSTM1 zur Gewebespezifität der Entgiftung bei: In der Lunge ist es besonders wichtig zur Neutralisierung inhalierter Schadstoffe, während es in der Leber zur Phase-II-Verarbeitung von Arzneimittelmetaboliten beiträgt. GSTM1 agiert somit nicht statisch, sondern dynamisch, abhängig von Umweltfaktoren, Ernährung, Medikamenteneinnahme und dem allgemeinen Stoffwechselzustand. Bei erhöhter Toxinexposition, etwa durch Rauchen, Luftverschmutzung oder bestimmten Berufsrisiken, ist eine hohe GSTM1-Aktivität entscheidend, um eine übermäßige oxidative Belastung und zelluläre Schädigung zu verhindern.
Die Fähigkeit unseres Körpers, chemische Schadstoffe und reaktive Zwischenprodukte effektiv zu entgiften, hängt maßgeblich von bestimmten Enzymen der sogenannten Phase-II-Entgiftung ab. Eines dieser Enzyme ist Glutathion-S-Transferase Mu 1 (GSTM1), das vor allem in Leber, Lunge und Nieren aktiv ist. Es sorgt dafür, dass toxische Moleküle mithilfe von Glutathion gebunden und anschließend aus dem Körper ausgeschieden werden können. Ob dieses Enzym im Körper gebildet wird oder nicht, ist genetisch festgelegt und genau hier setzt die GSTM1-Analyse von NovoMedic an.
Im Fokus steht dabei die Frage, ob das GSTM1-Gen vorhanden (INS) oder gelöscht (DEL) ist. Bei etwa 56 % der Bevölkerung liegt das Gen in funktionsfähiger Form vor. In diesem Fall ist die zelluläre Entgiftung durch GSTM1 aktiv, insbesondere gegenüber lipophilen Umweltgiften wie polyzyklischen aromatischen Kohlenwasserstoffen oder bestimmten Medikamentenmetaboliten. Das Enzym unterstützt den Körper darin, chemische Belastungen zügig zu verarbeiten und die oxidative Stresslast auf niedrigem Niveau zu halten. Bei diesen Personen funktioniert das entgiftende Glutathion-System in vollem Umfang, ein bedeutender Vorteil in einer zunehmend toxingeladenen Umwelt. Anders sieht es bei den rund 44 % der Menschen aus, bei denen das GSTM1-Gen vollständig fehlt (DEL). In solchen Fällen wird das zugehörige Enzym nicht gebildet, was dazu führt, dass bestimmte Schadstoffe nur eingeschränkt neutralisiert werden können. Die Reaktionsprodukte aus Phase I, oft aggressive Zwischenverbindungen, verbleiben länger im Gewebe und können dort oxidativen Schaden verursachen. Besonders in belastenden Situationen, etwa bei hoher Schadstoffexposition, regelmäßigem Medikamentenkonsum oder chronischen Entzündungsprozessen, kann das gesundheitliche Risiko dadurch spürbar steigen. Die GSTM1-Deletionsvariante gilt daher als bedeutender Risikofaktor für eine verminderte Entgiftungsleistung. Studien zeigen, dass betroffene Personen häufiger auf Umweltchemikalien sensibel reagieren, schlechter auf oxidativen Stress regulieren und ein erhöhtes Risiko für bestimmte Erkrankungen aufweisen. Etwa für chronisch-entzündliche Prozesse, Atemwegserkrankungen oder toxisch bedingte Zellveränderungen.
Die Kenntnis des individuellen GSTM1-Status kann deshalb ein wertvoller Baustein für eine personalisierte Prävention sein. Besonders bei nachgewiesenem DEL-Status empfiehlt sich eine gezielte Unterstützung der körpereigenen Entgiftungssysteme. Durch die Zufuhr von N-Acetylcystein zur Glutathionbildung, Sulforaphan zur Aktivierung alternativer Phase-II-Enzyme, sowie antioxidative Mikronährstoffe wie Selen, Vitamin C, Alpha-Liponsäure oder Zink. Ebenso wichtig ist eine bewusste Vermeidung unnötiger Toxinbelastungen – z. B. durch schadstoffarme Ernährung, gute Raumluftqualität und die Auswahl verträglicher Pflegeprodukte. Die GSTM1-Analyse liefert somit nicht nur Erkenntnisse über die genetische Entgiftungskapazität, sondern schafft auch die Grundlage für individuelle Empfehlungen zur Stärkung der Zellresilienz und langfristigen Gesundheit.
Das GSTT1-Gen (Glutathion-S-Transferase Theta 1) kodiert für das gleichnamige Enzym GSTT1, das eine zentrale Rolle in der biochemischen Entgiftung kleiner, reaktiver Chemikalien spielt. Das Gen ist auf Chromosom 22 in der Region q11.23 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 11.000 Basenpaare. Das von GSTT1 exprimierte Enzym gehört zur Familie der Glutathion-S-Transferasen (GSTs), einer Gruppe von Phase-II-Enzymen, die für die Konjugation von Glutathion (GSH) mit toxischen Substanzen verantwortlich sind. GSTT1 wird hauptsächlich in der Leber, aber auch in Darm, Niere und anderen entgiftungsaktiven Geweben exprimiert. Seine Hauptfunktion besteht darin, kleine elektrophile Moleküle, die in Phase I durch Oxidation entstehen, wasserlöslich zu machen und so ihre Ausscheidung zu ermöglichen. Das GSTT1-Enzym katalysiert nicht selbst die Umwandlung von Lipophilen zu hydrophilen Substanzen im klassischen Sinne, sondern ist entscheidend an der Phase-II-Reaktion beteiligt, bei der das hochreaktive Substrat durch Bindung mit Glutathion neutralisiert wird. Dies betrifft insbesondere Substanzen wie Benzol, Halogenkohlenwasserstoffe, Oxiranverbindungen sowie reaktive Metabolite bestimmter Medikamente. GSTT1 moduliert damit direkt die Toxizität solcher Substanzen, indem es verhindert, dass sie mit zellulären Strukturen wie DNA, Proteinen oder Lipidmembranen reagieren. In Anwesenheit von funktionell aktivem GSTT1 läuft dieser Entgiftungsprozess effizient ab: Die reaktiven Metabolite werden zügig konjugiert, ihre Halbwertszeit im Organismus verkürzt sich deutlich, und das Risiko einer Zellschädigung durch oxidative Prozesse oder kovalente Bindungen an Zellbestandteile sinkt. Die Entgiftungskapazität über GSTT1 ist damit besonders wichtig für den Schutz vor industriellen Lösungsmitteln, Umweltchemikalien und bestimmten Arzneistoffen. Darüber hinaus beeinflusst GSTT1 indirekt auch andere zelluläre Systeme, etwa durch seine Rolle im Erhalt des redoxaktiven Gleichgewichts. Durch den Glutathionverbrauch während der Konjugation interagiert GSTT1 funktionell mit dem Glutathion-Recycling (über Glutathion-Reduktase) und wirkt damit als Regulator im antioxidativen Schutzsystem der Zelle. Seine Aktivität ist eng an Stoffwechselsituationen mit hoher oxidativer Belastung gekoppelt, etwa bei chronischen Entzündungen, medikamentöser Dauertherapie oder exogener Toxinexposition.
Damit chemische Substanzen und Umweltgifte im Körper effizient entgiftet und ausgeschieden werden können, braucht es das funktionell aktive Enzym Glutathion-S-Transferase Theta 1 (GSTT1) und damit ein intaktes GSTT1-Gen. Eine Besonderheit des GSTT1-Gens liegt in der möglichen vollständigen Deletion, dem sogenannten Null-Allel (DEL), bei der das Gen nicht exprimiert wird und somit auch kein funktionsfähiges Enzym gebildet werden kann.
Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung des GSTT1-Genotyps (INS oder DEL) die individuelle Entgiftungsleistung gegenüber bestimmten Chemikalien abgeschätzt werden. Der funktionsfähige Genotyp (INS) ist bei etwa 74 % der Bevölkerung vorhanden und sorgt dafür, dass das GSTT1-Enzym in physiologischer Menge aktiv ist. In diesem Fall ist die Fähigkeit des Körpers zur Bindung und Neutralisierung toxischer Substanzen, wie z. B. Benzol, Halogenverbindungen oder bestimmten Medikamentenmetaboliten, erhalten. Die chemischen Reaktionsprodukte aus Phase I werden zuverlässig weiterverarbeitet und können schnell aus dem Organismus entfernt werden. Bei rund 26 % der Bevölkerung liegt jedoch der DEL-Genotyp vor, bei dem beide Allele deletiert sind. In diesem Fall wird kein funktionelles GSTT1-Enzym gebildet. Das bedeutet: Bestimmte Toxine können nicht mehr ausreichend mit Glutathion konjugiert und ausgeschieden werden. Die Folge ist eine verlängerte Verweildauer chemisch reaktiver Substanzen im Gewebe, eine erhöhte Belastung durch oxidativen Stress und ein potenziell höheres Risiko für DNA-Schäden, Entzündungen oder andere zelluläre Dysfunktionen. Menschen mit dieser genetischen Variante zeigen häufig eine verminderte Entgiftungskapazität, insbesondere bei gleichzeitiger Exposition gegenüber Umweltchemikalien, Industrieemissionen, Abgasen oder bestimmten Arzneistoffen. Langfristig kann die eingeschränkte Funktion von GSTT1 mit einem erhöhten Risiko für gesundheitliche Folgeprobleme einhergehen. Dazu zählen unter anderem toxisch bedingte Leberschäden, chronische Entzündungsprozesse, erhöhte Empfindlichkeit gegenüber bestimmten Medikamenten, und bei starker Exposition möglicherweise auch ein erhöhtes Risiko für bestimmte Krebsarten.
Die Kenntnis des individuellen GSTT1-Status bietet daher wertvolle Hinweise für eine personalisierte Präventionsstrategie. Personen mit DEL-Genotyp können durch gezielte Maßnahmen unterstützt werden, etwa durch die Einnahme von Glutathion-Vorstufen wie N-Acetylcystein (NAC), die gezielte Zufuhr antioxidativer Mikronährstoffe wie Vitamin C, Selen oder Alpha-Liponsäure, sowie durch den Einsatz von induktiven Pflanzenstoffen wie Sulforaphan, das andere Entgiftungsenzyme aktiviert.
Eine eingeschränkte Fähigkeit zur Entgiftung von Umweltgiften, Medikamentenrückständen oder industriellen Schadstoffen kann das Risiko für chronische Entzündungen, neurologische Störungen und zelluläre Schäden erhöhen. Genetische Varianten in den Entgiftungsgenen GSTM1, GSTT1 und GSTP1 beeinflussen, wie effizient der Körper toxische Substanzen mit Glutathion neutralisiert und ausscheidet. Liegt eine genetische Schwäche vor, bleiben chemisch reaktive Verbindungen länger im Körper und belasten Zellen, Leber und Nervensystem. Das macht präzise Prävention und gezielte Unterstützung der körpereigenen Entgiftungsleistung besonders wichtig.
Empfehlenswert ist eine frische, schadstoffarme Ernährung mit vielen pflanzlichen Lebensmitteln, Bitterstoffen und schwefelhaltigem Gemüse wie Brokkoli, Rucola, Lauch oder Rettich. Diese regen die körpereigene Phase-II-Entgiftung an. Stark verarbeitete Lebensmittel, Konservierungsstoffe, Grillprodukte und Alkohol sollten dagegen möglichst gemieden werden, da sie das Entgiftungssystem zusätzlich fordern oder toxische Zwischenprodukte erzeugen. Bestimmte Mikronährstoffe, insbesondere N-Acetylcystein (NAC) als Vorstufe von Glutathion, Selen, Zink, Vitamin C, Alpha-Liponsäure und aktive B-Vitamine unterstützen die Glutathion-Synthese und schützen vor oxidativem Stress. Ergänzend können sekundäre Pflanzenstoffe wie Sulforaphan, Curcumin, OPC oder Polyphenole aus grünem Tee die Aktivität entgiftungsrelevanter Enzyme gezielt stimulieren. Wichtig ist zudem ein aktiver Lebensstil: regelmäßige Bewegung, insbesondere moderates Ausdauertraining und Sauna, kann die Leberdurchblutung, den Lymphfluss und die körpereigene Entgiftung deutlich verbessern. Auch regelmäßige Essenspausen (z. B. durch Intervallfasten) unterstützen den Zellstoffwechsel und helfen, oxidativen Stress abzubauen. Ausreichend Schlaf und der bewusste Umgang mit Umweltreizen (z. B. in der Raumluft, bei Körperpflegeprodukten oder Reinigungsmitteln) sind weitere Bausteine einer ganzheitlichen Entgiftungsstrategie.
Alnasser, S. M. (2025). The role of glutathione S-transferases in human disease pathogenesis and their current inhibitors. Genes & Diseases, 12(4), 101482. https://doi.org/10.1016/j.gendis.2024.101482
Antwerpes, F., Fink, B., Schuster, M., Christof, A.-M., Güler, I., Adelsberger, A., Paulussen, U., & Högemann, A. (2004). Biotransformation. DocCheck Flexikon. Abgerufen am 17. Juni 2025 von https://flexikon.doccheck.com/de/Biotransformation
flexikon.doccheck.com
Averill-Bates D. A. (2023). The antioxidant glutathione. Vitamins and hormones, 121, 109–141. https://doi.org/10.1016/bs.vh.2022.09.002
Forman, H. J., Zhang, H., & Rinna, A. (2009). Glutathione: overview of its protective roles, measurement, and biosynthesis. Molecular aspects of medicine, 30(1-2), 1–12. https://doi.org/10.1016/j.mam.2008.08.006
Iyanagi, T. (2007). Molecular mechanism of Phase I and Phase II drug‐metabolizing enzymes: Implications for detoxification. In International Review of Cytology (Vol. 260, pp. 35–112). Academic Press. https://doi.org/10.1016/S0074-7696(06)60002-8
Mazari, A. M. A., Zhang, L., Ye, Z. W., Zhang, J., Tew, K. D., & Townsend, D. M. (2023). The Multifaceted Role of Glutathione S-Transferases in Health and Disease. Biomolecules, 13(4), 688. https://doi.org/10.3390/biom13040688
Libretexts. (2024, 30. Dezember). 1.5: drug metabolism. Chemistry LibreTexts. https://chem.libretexts.org/Bookshelves/Biological_Chemistry/An_Introduction_to_Medicinal_Chemistry_and_Molecular_Recognition_%28de_Araujo_et_al.%29/01%3A_Chapters/1.05%3A_Drug_Metabolism
Phase I and Phase II metabolism | Medicinal Chemistry Class Notes | Fiveable. (o. D.). Fiveable. https://library.fiveable.me/medicinal-chemistry/unit-9/phase-phase-ii-metabolism/study-guide/kTyzFtLERbJ66rdp
Gong, J. Y., Peng, S. Y., Xing, K., Fan, L., Tan, S. L., Luo, Z. Y., Yuan, H. Y., Xu, P., & Luo, J. Q. (2021). Evaluating the role of GSTP1 genetic polymorphism (rs1695, 313A>G) as a predictor in cyclophosphamide-induced toxicities. Medicine, 100(11), e24423. https://doi.org/10.1097/MD.0000000000024423
PharmGKB. (o. D.). PharmGKB. https://www.pharmgkb.org/literature/13938570
rs1695 – SNPedia. (o. D.). https://www.snpedia.com/index.php/Rs1695
GSTM1 glutathione S-transferase mu 1 [Homo sapiens (human)] – Gene – NCBI. (o. D.). https://www.ncbi.nlm.nih.gov/gene/2944
Peck, E. C., & Eaton, D. L. (2010). Genetic polymorphism and susceptibility to pesticides. In R. Krieger (Ed.), Hayes‘ handbook of pesticide toxicology (3rd ed., pp. 525–549). Academic Press. https://doi.org/10.1016/B978-0-12-374367-1.00017-3
Qiu, L. X., Wang, K., Lv, F. F., Chen, Z. Y., Liu, X., Zheng, C. L., Li, W. H., Zhu, X. D., Guo, W. J., & Li, J. (2011). GSTM1 null allele is a risk factor for gastric cancer development in Asians. Cytokine, 55(1), 122–125. https://doi.org/10.1016/j.cyto.2011.03.004
Disposition, I. F. P. U. G. (o. D.). Glutathion S-Transferase T1 (GSTT1) – www.ipgd-labore.de. Institut für Pharmakogenetik und Genetische Disposition. https://ipgd-labore.de/papoo/institut-leistungsspektrum/a-z/glutathion-s-transferase-t1/glutathion-s-transferase-t1.html#:~:text=Glutathion%20S-Transferasen%20sind%20Enzyme,und%20k%C3%B6rperfremder%20Stoffe%20wird%20erleichtert
GeneCards. (2025). GSTT1 (Glutathione S-transferase theta 1) [Homo sapiens (human)]. Abrufbar unter https://www.genecards.org/cgi-bin/carddisp.pl?gene=GSTT1
GSTT1 glutathione S-transferase theta 1 [Homo sapiens (human)] – Gene – NCBI. (o. D.). https://www.ncbi.nlm.nih.gov/gene/2952#:~:text=The%20interaction%20with%20the%20GSTT1,pooled%20into%20this%20meta-analysis
Muro-Perez, M., González-Martínez, G., Martínez-García, P., Legaz, I., Zafrilla, P., & Muro, M. (2023). Analysis of null deletion polymorphism of glutathione S-transferase theta (GSTT-1), associated with anti-GSTT-1 antibodies development in transplantation. International journal of immunogenetics, 50(5), 264–271. https://doi.org/10.1111/iji.12635