Lesedauer: 30 Minuten

Lesedauer: 30 Minuten
LDL-Cholesterin ist ein zentraler Marker in der kardiometabolischen Risikobewertung. Seine zelluläre Verarbeitung und systemische Konzentration hängen maßgeblich von genetischen Faktoren ab, die die Synthese, Zusammensetzung, Rezeptorbindung und hepatische Clearance der LDL-Partikel regulieren. In diesem Beitrag beleuchten wir die molekularen Rollen der Gene APOB, SREBP2 und APOE im Cholesterinstoffwechsel und diskutieren ihre klinische Relevanz für personalisierte Prävention und Therapie bei Hypercholesterinämie und atherosklerotischen Erkrankungen.
LDL-Cholesterin wird über LDL-Partikel mit ApoB-100 zu den Zellen transportiert. Die Aufnahme erfolgt über LDL-Rezeptoren, deren Expression durch das Transkriptionsfaktor-Gen SREBP2 gesteuert wird. APOE unterstützt zusätzlich die Aufnahme von Lipoproteinresten. Genvarianten in APOB, SREBP2 oder APOE können die LDL-Clearance beeinträchtigen und das Risiko für Atherosklerose erhöhen.
Für die medizinische Praxis ist wichtig, dass genetische Analysen helfen, Risikopatient:innen mit gestörter LDL-Aufnahme frühzeitig zu identifizieren. Eine individuelle Kombination aus cholesterinsenkender Ernährung, Bewegung und gezielter Mikronährstoffgabe (z. B. Omega-3, Pflanzensterine, Coenzym Q10) kann die LDL-Werte wirksam regulieren.
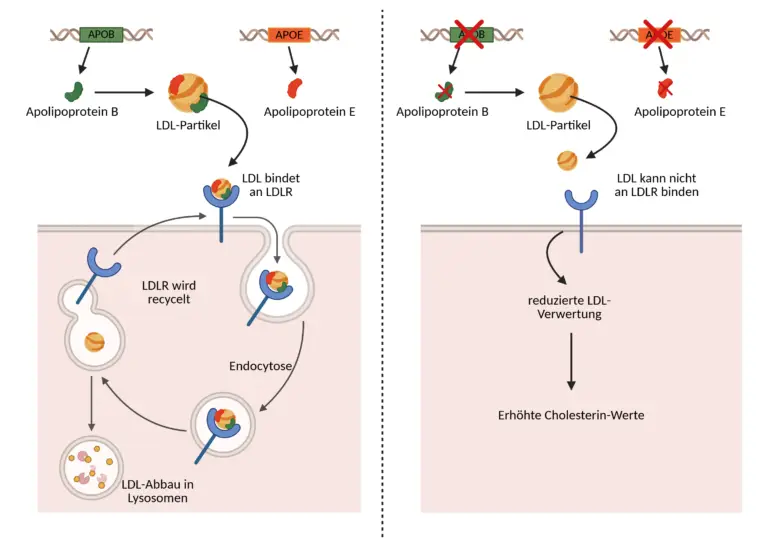
Low-Density Lipoprotein-Cholesterin (LDL-C) ist einer der zentralen Transportformen von Cholesterin im menschlichen Blutkreislauf. Cholesterin selbst ist ein lebenswichtiger Bestandteil biologischer Membranen, Vorläufermolekül für Steroidhormone, Gallensäuren sowie Vitamin D und spielt eine fundamentale Rolle in der Zellfunktion und -kommunikation. Da Cholesterin im wässrigen Blutplasma nicht frei löslich ist, wird es in Form lipoproteinbasierter Transportpartikel durch den Körper transportiert. Die LDL-Partikel übernehmen dabei primär den Transport von Cholesterin aus der Leber zu peripheren Geweben, wo es in zelluläre Prozesse eingebaut oder gespeichert wird. Ein typischer LDL-Partikel besteht aus einer hydrophoben Lipidkernstruktur aus Cholesterinestern und Triglyzeriden, umgeben von einer Hülle aus Phospholipiden, freiem Cholesterin und dem Apolipoprotein B-100 (ApoB-100). Dieses Protein übernimmt eine doppelte Funktion: Es stabilisiert die Partikelstruktur und vermittelt zugleich die Bindung an LDL-Rezeptoren (LDLR) auf der Oberfläche von Zielzellen, insbesondere Hepatozyten. Die Aufnahme von LDL-Partikeln in die Zelle erfolgt über rezeptorvermittelte Endozytose, woraufhin der Partikel in Lysosomen abgebaut wird und das Cholesterin der Zelle zur Verfügung steht. Die homöostatische Kontrolle des LDL-Cholesterinspiegels im Blut ist ein hochregulierter Prozess, der durch ein Zusammenspiel von Cholesterinaufnahme, endogener Synthese, Verwertung und Ausscheidung gesteuert wird. Eine zentrale Rolle dabei spielen drei genetische Faktoren: APOB, SREBP2 und APOE. Sie beeinflussen jeweils unterschiedliche, aber eng miteinander verzahnte molekulare Mechanismen, die über die Höhe und Zusammensetzung des LDL-C im Serum entscheiden.
Das APOB-Gen kodiert für das Strukturprotein ApoB-100. Dieses Protein ist nicht nur für die korrekte Bildung von LDL-Partikeln notwendig, sondern auch für deren Erkennung durch die LDL-Rezeptoren. Spezifische Domänen innerhalb der ApoB-Struktur binden an LDLR und ermöglichen so die zelluläre Aufnahme des Partikels.
Das SREBP2-Gen (Sterol Regulatory Element-Binding Protein 2) reguliert auf transkriptioneller Ebene die Cholesterinhomöostase innerhalb der Zelle. Es kodiert für einen membranständigen Vorläufer eines Transkriptionsfaktors, der im endoplasmatischen Retikulum gebunden vorliegt und bei niedrigem intrazellulärem Cholesterinstatus aktiviert wird. Nach proteolytischer Prozessierung im Golgi-Apparat wird der aktive Teil von SREBP2 in den Zellkern transloziert, wo er an sterol regulatory elements (SREs) in den Promotorregionen zahlreicher Gene bindet. Zu den Zielgenen zählen unter anderem HMG-CoA-Reduktase (HMGCR), das für die Cholesterinsynthese wichtig ist und das LDLR-Gen, das die Bildung von LDL-Rezeptoren anregt. Auf diese Weise erhöht SREBP2 sowohl die Fähigkeit der Zelle, Cholesterin selbst zu synthetisieren, als auch LDL-Partikel aus dem Blut aufzunehmen.
Ein dritter bedeutender Faktor ist das APOE-Gen, das für Apolipoprotein E kodiert. Die Genvarianten E2, E3 und E4 unterscheiden sich jeweils in ihrer Bindungsaffinität und beeinflussen den Fettstoffwechsel unterschiedlich stark. Während E3 als neutrale Standardform gilt, zeigt E2 eine verminderte Rezeptorbindung, was bei Homozygotie zu einer gestörten Verwertung von Remnant-Partikeln und zur familiären Dysbetalipoproteinämie führen kann. Remnant-Partikel sind Restpartikel, die im Körper während des Fettstoffwechsels entstehen. Sie entstehen, wenn große, fettreiche Transportpartikel, wie etwa Chylomikronen (aus der Nahrung) oder VLDL (von der Leber gebildet), einen Teil ihrer Triglyzeride an Körperzellen abgegeben haben. Dabei schrumpfen sie und es bleiben kleinere, cholesterinreichere Partikel zurück: die sogenannten Remnants. Diese Remnant-Partikel sind besonders interessant, weil sie in einem engen Zusammenhang mit LDL-Cholesterin (LDL-C) stehen. Aus den VLDL-Remnants entsteht nämlich im weiteren Verlauf LDL, also das „schlechte Cholesterin“. Gleichzeitig können Remnants aber auch selbst zur Ablagerung von Cholesterin in den Gefäßwänden beitragen, weil sie viel Cholesterin enthalten und leicht in das Gefäßinnere eindringen können. Normalerweise werden Remnant-Partikel über die Leber wieder aus dem Blut entfernt, vor allem mithilfe des Proteins Apolipoprotein E (ApoE), dass ihnen beim Erkennen und Binden an Leberzellen hilft. Das E4-Allel hingegen ist mit einer ineffizienten Lipoproteinaufnahme und einem erhöhten LDL-Cholesterinspiegel assoziiert. Es ist zudem ein etablierter genetischer Risikofaktor sowohl für kardiovaskuläre Erkrankungen als auch für spätmanifestierende Alzheimer-Erkrankungen.
Das Zusammenspiel dieser drei Gene definiert auf molekularer Ebene die Effizienz des LDL-Stoffwechsels: APOB bestimmt die Qualität und Bindungsfähigkeit des LDL-Partikels, SREBP2 steuert die Synthese und Rezeptordichte in Abhängigkeit vom zellulären Cholesterinstatus, und APOE reguliert die Remnant-vermittelte Cholesterinaufnahme in der Leber. Abweichungen in einem oder mehreren dieser genetischen Pfade können individuell oder synergistisch zu einer erhöhten LDL-Cholesterinkonzentration im Blut führen.
Das APOB-Gen (Apolipoprotein B) kodiert für das Strukturprotein Apolipoprotein B, das eine zentrale Rolle im Lipidstoffwechsel und insbesondere in der Regulation von LDL-Cholesterin spielt. Das Gen ist auf Chromosom 2, genauer an der Position 2p24.1 (kurzer Arm des Chromosoms), lokalisiert und umfasst etwa 43.000 Basenpaare. Durch alternatives Spleißen und RNA-Editing entstehen aus dem APOB-Gen zwei verschiedene Proteinprodukte: Apolipoprotein B-100 (ApoB-100), das in der Leber exprimiert wird, und Apolipoprotein B-48 (ApoB-48), das im Dünndarm gebildet wird.
ApoB-100 erfüllt zwei Hauptfunktionen: Einerseits wirkt es als strukturelles Gerüst für Lipoproteine wie VLDL (Very Low-Density Lipoprotein), IDL (Intermediate-Density Lipoprotein) und LDL, indem es hydrophobe Lipidkerne im wässrigen Milieu des Blutplasmas stabilisiert. Andererseits ist es der funktionelle Ligand für den LDL-Rezeptor (LDLR). Dieser Rezeptor befindet sich auf der Zellmembran vieler Körperzellen, vor allem aber auf Hepatozyten in der Leber, dem Hauptorgan für die Entfernung von LDL aus dem Blutkreislauf. Die Bindung von LDL an den LDL-Rezeptor ist ein hochspezifischer, rezeptorvermittelter Prozess: Auf der Oberfläche des LDL-Partikels befindet sich eine definierte, ligandenspezifische Region des ApoB-100, die eine komplementäre Struktur zum extrazellulären Teil des LDL-Rezeptors aufweist. Nach erfolgreicher Interaktion zwischen dem LDL-C und dem LDLR wird der gesamte LDL-ApoB-LDLR-Komplex über Clathrin-beschichtete Vesikel in die Zelle aufgenommen. Ein Vorgang, der als rezeptorvermittelte Endozytose bezeichnet wird. Im Inneren der Zelle wird der Vesikel zunächst in Endosomen überführt, in denen durch Ansäuerung der pH-Wert gesenkt wird. Dies führt dazu, dass sich der LDL-Rezeptor vom LDL-Partikel löst und zurück zur Zelloberfläche recycelt wird. Der LDL-Partikel wird hingegen in Lysosomen eingeschleust, wo seine Bestandteile ApoB-100, Cholesterinester und Phospholipide enzymatisch abgebaut werden. Das freigesetzte Cholesterin steht der Zelle dann für den Einbau in Membranen, die Synthese von Gallensäuren oder die Rückkopplung auf die Cholesterinregulation zur Verfügung. Diese effiziente Aufnahme und Verwertung von LDL ist essenziell für die Aufrechterhaltung der Cholesterin-Homöostase im Körper. Der LDL-Rezeptorzyklus ist dabei auf die unveränderte Struktur und Präsenz von ApoB-100 angewiesen, denn nur so kann LDL vom Rezeptor erkannt, gebunden und aufgenommen werden. ApoB-100 ist somit nicht nur strukturell integraler Bestandteil des LDL-Partikels, sondern auch funktionell der Schlüssel für dessen zellulären Abbau.
Darüber hinaus ist die Regulation des LDL-Rezeptors eng mit dem intrazellulären Cholesterinspiegel verbunden. Wenn die Zelle ausreichend Cholesterin enthält, wird die Expression des LDLR-Gens gehemmt, was zu einer reduzierten Aufnahme von LDL führt. Umgekehrt führt ein Mangel an zellulärem Cholesterin zu einer Aktivierung des Transkriptionsfaktors SREBP2, der die Expression von LDL-Rezeptoren steigert, das wiederum eine erhöhte LDL-Aufnahme aus dem Blut bewirkt. ApoB-100 ist hierbei die konstante Zielstruktur auf LDL, über die dieser Regulationsmechanismus realisiert wird. Insgesamt ist das APOB-Gen mit seinem Proteinprodukt ApoB-100 ein zentraler molekularer Vermittler zwischen Cholesterintransport, zellulärer Aufnahme und Stoffwechselregulation. Die Interaktion von ApoB-100 mit dem LDL-Rezeptor stellt einen kritischen Schritt in der Kontrolle des LDL-Spiegels im Blut dar und ist damit maßgeblich an der Vermeidung von Cholesterinakkumulation und atherogenen Prozessen beteiligt.
Damit LDL-Cholesterin (LDL-C) im Körper effizient abgebaut werden kann, ist eine funktionierende Bindung der LDL-Partikel an die LDL-Rezeptoren (LDLR) auf der Zelloberfläche essenziell. Eine Schlüsselrolle in diesem Prozess spielt das APOB-Gen, das für das Strukturprotein Apolipoprotein B-100 (ApoB-100) kodiert. Ein relevanter genetischer Marker in diesem Zusammenhang ist der Einzelnukleotidpolymorphismus rs5742904, bei dem es zu einem Austausch der Base Cytosin (C) durch Thymin (T) kommt. Diese Mutation führt zu einer Aminosäureveränderung, bei der anstelle von Glutamin (Q) an Position 3614 ein Stopcodon eingebaut wird. Das hat zur Folge, dass die Translation des ApoB-100-Proteins vorzeitig abgebrochen wird. Das entstehende Protein ist somit verkürzt und kann seine Funktion als Ligand des LDL-Rezeptors nicht mehr zuverlässig erfüllen.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung des Genotyps (C/C, C/T oder T/C und T/T) die individuelle Ausgangslage im Hinblick auf die ApoB-100-Funktion beurteilt werden. Bei Personen mit dem Genotyp C/C, der bei etwa 98 % der Bevölkerung vorkommt, ist die ursprüngliche, vollständige Genvariante auf beiden Allelen vorhanden. Das bedeutet, dass ApoB-100 vollständig synthetisiert werden kann und die LDL-Rezeptorbindung in der Regel ungestört funktioniert. Die LDL-Aufnahme in die Leber verläuft effizient, sodass der Cholesterinspiegel im Blut im physiologischen Bereich gehalten werden kann. Träger des C/T oder T/C-Genotyps, der etwa 1 % der Bevölkerung betrifft, verfügen über eine veränderte Base auf einem der beiden Allele. Das führt dazu, dass sowohl vollständige als auch verkürzte ApoB-100-Proteine gebildet werden. Die Folge kann eine eingeschränkte Rezeptorbindung und damit eine reduzierte LDL-Verwertung sein. Besonders bei zusätzlichem Bewegungsmangel, ungünstiger Ernährung oder anderen Risikofaktoren kann dies zu einem moderat erhöhten LDL-Cholesterinspiegel führen. Eine cholesterinbewusste Ernährung, regelmäßige Bewegung und gegebenenfalls die gezielte Unterstützung des Lipidstoffwechsels mit Mikronährstoffen (z. B. Omega-3-Fettsäuren oder Pflanzensterinen) sind hier besonders empfehlenswert. Bei Personen mit dem seltenen T/T-Genotyp, der bei ca. 1 % der Bevölkerung vorkommt, liegt die Stoppmutation auf beiden Allelen vor. In diesen Fällen ist die Fähigkeit zur Produktion funktioneller ApoB-100-Proteine stark eingeschränkt. Die LDL-Rezeptorbindung funktioniert kaum noch, was zu einer stark verminderten LDL-Aufnahme in die Leber führt. In der Folge verbleiben große Mengen LDL-Cholesterin im Blut, was das Risiko für Hypercholesterinämie, Atherosklerose und kardiovaskuläre Erkrankungen erheblich erhöht. Betroffenen mit diesem Genotyp wird eine besonders konsequente Kontrolle der Blutfettwerte und frühzeitige therapeutische Intervention empfohlen. Dazu gehören gezielte Ernährungstherapien, ein aktiver Lebensstil sowie gegebenenfalls medikamentöse Lipidsenkung, etwa durch Statine oder PCSK9-Inhibitoren.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung des Genotyps (C/C, C/T oder T/C und T/T) die individuelle Ausgangslage im Hinblick auf die ApoB-100-Funktion beurteilt werden. Bei Personen mit dem Genotyp C/C, der bei etwa 98 % der Bevölkerung vorkommt, ist die ursprüngliche, vollständige Genvariante auf beiden Allelen vorhanden. Das bedeutet, dass ApoB-100 vollständig synthetisiert werden kann und die LDL-Rezeptorbindung in der Regel ungestört funktioniert. Die LDL-Aufnahme in die Leber verläuft effizient, sodass der Cholesterinspiegel im Blut im physiologischen Bereich gehalten werden kann. Träger des C/T oder T/C-Genotyps, der etwa 1 % der Bevölkerung betrifft, verfügen über eine veränderte Base auf einem der beiden Allele. Das führt dazu, dass sowohl vollständige als auch verkürzte ApoB-100-Proteine gebildet werden. Die Folge kann eine eingeschränkte Rezeptorbindung und damit eine reduzierte LDL-Verwertung sein. Besonders bei zusätzlichem Bewegungsmangel, ungünstiger Ernährung oder anderen Risikofaktoren kann dies zu einem moderat erhöhten LDL-Cholesterinspiegel führen. Eine cholesterinbewusste Ernährung, regelmäßige Bewegung und gegebenenfalls die gezielte Unterstützung des Lipidstoffwechsels mit Mikronährstoffen (z. B. Omega-3-Fettsäuren oder Pflanzensterinen) sind hier besonders empfehlenswert. Bei Personen mit dem seltenen T/T-Genotyp, der bei ca. 1 % der Bevölkerung vorkommt, liegt die Stoppmutation auf beiden Allelen vor. In diesen Fällen ist die Fähigkeit zur Produktion funktioneller ApoB-100-Proteine stark eingeschränkt. Die LDL-Rezeptorbindung funktioniert kaum noch, was zu einer stark verminderten LDL-Aufnahme in die Leber führt. In der Folge verbleiben große Mengen LDL-Cholesterin im Blut, was das Risiko für Hypercholesterinämie, Atherosklerose und kardiovaskuläre Erkrankungen erheblich erhöht. Betroffenen mit diesem Genotyp wird eine besonders konsequente Kontrolle der Blutfettwerte und frühzeitige therapeutische Intervention empfohlen. Dazu gehören gezielte Ernährungstherapien, ein aktiver Lebensstil sowie gegebenenfalls medikamentöse Lipidsenkung, etwa durch Statine oder PCSK9-Inhibitoren.
Das SREBP2-Gen (Sterol Regulatory Element-Binding Protein 2) kodiert für den Transkriptionsfaktor SREBP2, der eine zentrale Rolle im zellulären Cholesterinstoffwechsel spielt. Das Gen ist auf Chromosom 22 an der Position q13.2 (langer Arm des Chromosoms) lokalisiert und umfasst rund 60.000 Basenpaare. Das vom SREBP2-Gen codierte Protein ist essenziell für die Aktivierung zahlreicher Gene, die an der endogenen Cholesterinbiosynthese und an der Aufnahme von LDL-Cholesterin beteiligt sind. Dazu zählen unter anderem Gene für die HMG-CoA-Reduktase (Schlüsselenzym der Cholesterinsynthese) sowie für den LDL-Rezeptor (LDLR).
SREBP2 wird zunächst als inaktives Vorläuferprotein in der Membran des endoplasmatischen Retikulums (ER) synthetisiert. Es ist dort an ein Regulatorprotein, SCAP (SREBP cleavage-activating protein), gebunden. Der Aktivierungsmechanismus von SREBP2 ist eng an den zellulären Cholesterinstatus gekoppelt: Bei niedrigem Cholesterinspiegel verändert SCAP seine Konformation und transportiert SREBP2 mit Hilfe von Vesikeln in den Golgi-Apparat. Dort wird das Vorläuferprotein durch zwei spezifische Proteasen gespalten. Der nun freigesetzte N-terminale Teil von SREBP2, das aktive Transkriptionsfaktorfragment, gelangt in den Zellkern. Im Zellkern bindet SREBP2 an Sterol Regulatory Elements (SREs) in den Promotorregionen zielgerichteter Gene. Die Aktivierung dieser Gene führt zur verstärkten Cholesterinsynthese (u. a. durch Hochregulation der HMG-CoA-Reduktase) sowie zur vermehrten Expression von LDL-Rezeptoren, die für die Aufnahme von LDL-Cholesterin aus dem Blut verantwortlich sind. Der gesamte Regelkreis dient dazu, bei Cholesterinmangel die zelluläre Cholesterinversorgung sicherzustellen und gleichzeitig die Aufnahme von exogenem Cholesterin zu maximieren. Ist der intrazelluläre Cholesterinspiegel dagegen ausreichend hoch, wird der Transport von SREBP2 durch SCAP unterdrückt. Die Aktivierung von SREBP2 unterbleibt, was zur Runterregulation cholesterinsynthetisierender und -aufnehmender Gene führt. Diese Rückkopplung ist entscheidend, um eine übermäßige Cholesterinakkumulation in der Zelle zu verhindern.
Die Regulation durch SREBP2 ist ein kontinuierlich ablaufender Prozess, der fein auf äußere und innere Reize abgestimmt ist. Der Mechanismus ist besonders in der Leber aktiv, spielt aber auch in anderen Geweben wie dem ZNS, dem Nebennierenrinden- und Darmepithel sowie im Fettgewebe eine bedeutende Rolle. Eine gestörte Aktivität des SREBP2-Systems kann zu einer dauerhaften Überaktivierung von SREBP2 führen. Dies bewirkt eine zunehmende LDL-Rezeptorbildung und Cholesterinsynthese, was paradoxerweise zu erhöhtem Cholesterin im Blut beitragen kann, insbesondere wenn gleichzeitig die LDL-Rezeptorverwertung in der Leber eingeschränkt ist
Zusammenfassend ist das SREBP2-Gen von zentraler Bedeutung für die Aufrechterhaltung der Cholesterin-Homöostase. Durch seinen feinjustierten Regelmechanismus steuert es sowohl die endogene Cholesterinsynthese als auch die LDL-Aufnahme. Damit fungiert SREBP2 als Schaltzentrale der zellulären Cholesterinregulation, der permanent den Bedarf der Zelle erfasst und die notwendigen Gene aktiviert oder hemmt, um Cholesterin in der richtigen Menge zur Verfügung zu stellen.
Damit SREBP2 korrekt funktioniert, ist eine einwandfreie Struktur und Aktivierungskaskade notwendig. Diese kann durch genetische Varianten beeinflusst werden, insbesondere durch den Einzelnukleotidpolymorphismus rs2228314 im SREBP2-Gen. Im Rahmen von Genanalysen kann durch die Bestimmung des Genotyps (C/C, C/G oder G/C und G/G) die individuelle genetische Veranlagung zur funktionellen Aktivität von SREBP2 bewertet werden. Beim SNP rs2228314 kommt es zum Austausch der Base Cytosin (C) durch Guanin (G). Dies führt zu einer Aminosäureveränderung von Glycin zu Alanin an einer funktionell relevanten Position im Protein. Dieser Austausch kann die räumliche Struktur des Transkriptionsfaktors so verändern, dass seine Aktivität, insbesondere im Hinblick auf die Steuerung der Cholesterinaufnahme, beeinträchtigt wird.
Personen mit dem Genotyp C/C, der bei etwa 20 % der Bevölkerung vorkommt, tragen die ursprüngliche, funktionell intakte Basensequenz auf beiden Allelen. In diesen Fällen ist davon auszugehen, dass SREBP2 uneingeschränkt aktiv ist. Die Cholesterinsynthese und LDL-Rezeptorexpression reagieren sensibel auf den zellulären Cholesterinstatus, was eine effiziente Regulation der Cholesterinaufnahme aus dem Blut und damit eine ausgewogene Lipidbalance ermöglicht. Beim heterozygoten Genotyp C/G oder G/C, der mit etwa 41 % die häufigste Ausprägung in der Bevölkerung darstellt, liegt auf einem der beiden Allele die veränderte Base vor. Dies kann zu einer leicht veränderten Struktur des SREBP2-Proteins führen, was die Fähigkeit zur präzisen Aktivierung cholesterinregulierender Gene moderat beeinträchtigen kann. In der Folge kann die LDL-Rezeptorexpression etwas abgeschwächt sein, was die Aufnahme von LDL-Cholesterin in die Zellen verlangsamt. Dies kann insbesondere dann zu einem Anstieg des LDL-C-Spiegels im Blut führen, wenn zusätzlich eine cholesterinreiche Ernährung, Bewegungsmangel oder metabolische Störungen wie Insulinresistenz vorliegen. Bei Personen mit dem G/G-Genotyp, der bei etwa 39 % der Bevölkerung vorliegt, sind beide Allele verändert. Die daraus resultierende veränderte SREBP2-Struktur kann zu einer reduzierten Transkriptionsaktivität führen, insbesondere im Hinblick auf LDLR und HMG-CoA-Reduktase. Das bedeutet, dass die Fähigkeit der Zellen, LDL-Rezeptoren zu exprimieren und Cholesterin aus dem Blut aufzunehmen, eingeschränkt ist. Dies kann zu einer langsamen, aber chronischen Akkumulation von LDL-Cholesterin im Blut führen. Ein Risikofaktor für die Entwicklung von Atherosklerose und anderen kardiovaskulären Erkrankungen. Bei gleichzeitigem Vorliegen weiterer genetischer oder metabolischer Risikofaktoren kann die Situation zusätzlich verschärft werden.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung des Genotyps (C/C, C/T oder T/C und T/T) die individuelle Ausgangslage im Hinblick auf die ApoB-100-Funktion beurteilt werden. Bei Personen mit dem Genotyp C/C, der bei etwa 98 % der Bevölkerung vorkommt, ist die ursprüngliche, vollständige Genvariante auf beiden Allelen vorhanden. Das bedeutet, dass ApoB-100 vollständig synthetisiert werden kann und die LDL-Rezeptorbindung in der Regel ungestört funktioniert. Die LDL-Aufnahme in die Leber verläuft effizient, sodass der Cholesterinspiegel im Blut im physiologischen Bereich gehalten werden kann. Träger des C/T oder T/C-Genotyps, der etwa 1 % der Bevölkerung betrifft, verfügen über eine veränderte Base auf einem der beiden Allele. Das führt dazu, dass sowohl vollständige als auch verkürzte ApoB-100-Proteine gebildet werden. Die Folge kann eine eingeschränkte Rezeptorbindung und damit eine reduzierte LDL-Verwertung sein. Besonders bei zusätzlichem Bewegungsmangel, ungünstiger Ernährung oder anderen Risikofaktoren kann dies zu einem moderat erhöhten LDL-Cholesterinspiegel führen. Eine cholesterinbewusste Ernährung, regelmäßige Bewegung und gegebenenfalls die gezielte Unterstützung des Lipidstoffwechsels mit Mikronährstoffen (z. B. Omega-3-Fettsäuren oder Pflanzensterinen) sind hier besonders empfehlenswert. Bei Personen mit dem seltenen T/T-Genotyp, der bei ca. 1 % der Bevölkerung vorkommt, liegt die Stoppmutation auf beiden Allelen vor. In diesen Fällen ist die Fähigkeit zur Produktion funktioneller ApoB-100-Proteine stark eingeschränkt. Die LDL-Rezeptorbindung funktioniert kaum noch, was zu einer stark verminderten LDL-Aufnahme in die Leber führt. In der Folge verbleiben große Mengen LDL-Cholesterin im Blut, was das Risiko für Hypercholesterinämie, Atherosklerose und kardiovaskuläre Erkrankungen erheblich erhöht. Betroffenen mit diesem Genotyp wird eine besonders konsequente Kontrolle der Blutfettwerte und frühzeitige therapeutische Intervention empfohlen. Dazu gehören gezielte Ernährungstherapien, ein aktiver Lebensstil sowie gegebenenfalls medikamentöse Lipidsenkung, etwa durch Statine oder PCSK9-Inhibitoren.
Im Rahmen der genetischen Analysen von NovoMedic kann durch die Bestimmung des Genotyps (C/C, C/T oder T/C und T/T) die individuelle Ausgangslage im Hinblick auf die ApoB-100-Funktion beurteilt werden. Bei Personen mit dem Genotyp C/C, der bei etwa 98 % der Bevölkerung vorkommt, ist die ursprüngliche, vollständige Genvariante auf beiden Allelen vorhanden. Das bedeutet, dass ApoB-100 vollständig synthetisiert werden kann und die LDL-Rezeptorbindung in der Regel ungestört funktioniert. Die LDL-Aufnahme in die Leber verläuft effizient, sodass der Cholesterinspiegel im Blut im physiologischen Bereich gehalten werden kann. Träger des C/T oder T/C-Genotyps, der etwa 1 % der Bevölkerung betrifft, verfügen über eine veränderte Base auf einem der beiden Allele. Das führt dazu, dass sowohl vollständige als auch verkürzte ApoB-100-Proteine gebildet werden. Die Folge kann eine eingeschränkte Rezeptorbindung und damit eine reduzierte LDL-Verwertung sein. Besonders bei zusätzlichem Bewegungsmangel, ungünstiger Ernährung oder anderen Risikofaktoren kann dies zu einem moderat erhöhten LDL-Cholesterinspiegel führen. Eine cholesterinbewusste Ernährung, regelmäßige Bewegung und gegebenenfalls die gezielte Unterstützung des Lipidstoffwechsels mit Mikronährstoffen (z. B. Omega-3-Fettsäuren oder Pflanzensterinen) sind hier besonders empfehlenswert. Bei Personen mit dem seltenen T/T-Genotyp, der bei ca. 1 % der Bevölkerung vorkommt, liegt die Stoppmutation auf beiden Allelen vor. In diesen Fällen ist die Fähigkeit zur Produktion funktioneller ApoB-100-Proteine stark eingeschränkt. Die LDL-Rezeptorbindung funktioniert kaum noch, was zu einer stark verminderten LDL-Aufnahme in die Leber führt. In der Folge verbleiben große Mengen LDL-Cholesterin im Blut, was das Risiko für Hypercholesterinämie, Atherosklerose und kardiovaskuläre Erkrankungen erheblich erhöht. Betroffenen mit diesem Genotyp wird eine besonders konsequente Kontrolle der Blutfettwerte und frühzeitige therapeutische Intervention empfohlen. Dazu gehören gezielte Ernährungstherapien, ein aktiver Lebensstil sowie gegebenenfalls medikamentöse Lipidsenkung, etwa durch Statine oder PCSK9-Inhibitoren.
Das APOE-Gen (Apolipoprotein E) kodiert für das gleichnamige Protein Apolipoprotein E (ApoE), das eine zentrale Rolle im Lipoprotein-Stoffwechsel, insbesondere bei der Verwertung von Cholesterin und Triglyzeriden, spielt. Das Gen ist auf Chromosom 19 an der Position q13.32 (langer Arm des Chromosoms) lokalisiert und umfasst etwa 3.600 Basenpaare. ApoE ist ein struktureller und funktioneller Bestandteil von Lipoproteinen, vor allem von Chylomikronen-Remnants, VLDL (Very Low-Density Lipoprotein) und IDL (Intermediate-Density Lipoprotein).
Die Hauptfunktion von ApoE liegt in der Vermittlung der Aufnahme lipidhaltiger Partikel in die Leber, also im sogenannten Remnant-Clearance-Mechanismus. Dafür bindet ApoE an spezifische Rezeptoren auf der Zelloberfläche, vor allem an den LDL-Rezeptor (LDLR) sowie an LDL-Rezeptor-verwandte Proteine (z. B. LRP1). Diese Bindung ermöglicht es der Leberzelle, die cholesterin- und triglyceridreichen Partikel aus dem Blut aufzunehmen und im Zellinneren abzubauen. Das freiwerdende Cholesterin kann dann für den Aufbau von Zellmembranen, die Synthese von Gallensäuren oder die Hormonproduktion genutzt werden. ApoE ist damit ein zentraler Vermittler im Lipidstoffwechsel, insbesondere im sogenannten Reverse-Cholesterol-Transport, also dem Transport von überschüssigem Cholesterin aus dem Gewebe zurück zur Leber. Darüber hinaus spielt es auch eine Rolle bei der Regulation von Entzündungsprozessen, der zellulären Cholesterinhomöostase und dem Lipidstoffwechsel im zentralen Nervensystem. Ohne eine funktionierende ApoE-vermittelte Erkennung und Bindung der Lipoproteine an die Leberzellen würden diese Partikel deutlich langsamer oder unvollständig abgebaut werden. Dies könnte zu einer Akkumulation cholesterinreicher Lipoproteinreste im Blut führen, was langfristig das Risiko für Arteriosklerose und andere kardiovaskuläre Erkrankungen erhöhen kann. Eine gut funktionierende ApoE-abhängige Lipidaufnahme ist daher von großer Bedeutung für die Stabilität des Fettstoffwechsels und für die Gesundheit des Gefäßsystems.
Das APOE-Gen kommt in drei häufigen genetischen Varianten, den sogenannten Allelen ε2, ε3 und ε4, vor. Diese unterscheiden sich an zwei Positionen im Gen (den SNPs rs429358 und rs7412) jeweils durch einen Austausch einer einzelnen Base (Einzelnukleotidpolymorphismus). Diese kleinen Unterschiede führen zu einem Austausch von Aminosäuren im ApoE-Protein: an Position 112 und 158 des Proteins wird entweder Cystein oder Arginin eingebaut. Diese Veränderungen beeinflussen die räumliche Struktur und Oberflächenladung des ApoE-Proteins, was wiederum seine Bindungsfähigkeit an LDL-Rezeptoren verändert. Während das ε3-Allel die funktionell „neutrale“ Variante darstellt, sorgt das ε2-Allel für eine abgeschwächte Rezeptorbindung, und das ε4-Allel verändert die Konformation des Proteins so, dass Lipoproteine langsamer abgebaut werden. Jede Person besitzt zwei Kopien des APOE-Gens, eine von der Mutter, eine vom Vater, wodurch sich sechs mögliche Genotypen ergeben: ε2/ ε2, ε2/ ε3, ε2/ ε4, ε3 / ε3, ε3 / ε4 und ε4/ ε4. Diese Kombinationen bestimmen die individuelle Veranlagung zur LDL-Cholesterinregulation.
Im Rahmen der Genanalysen von NovoMedic kann durch die Bestimmung des APOE-Typs diese genetische Ausgangslage analysiert werden. Personen mit dem Genotyp ε2/ ε2, der bei etwa 1 % der Bevölkerung vorkommt, zeigen eine verringerte Bindungsfähigkeit von ApoE an LDL-Rezeptoren, jedoch wird dies durch einen kompensatorischen Mechanismus in der Leber ausgeglichen. Diese Personen haben daher eine genetische Schutzveranlagung gegenüber erhöhtem LDL-Cholesterin. Ihre LDL-Werte sind in der Regel niedrig bis normal, sofern keine anderen Störungen des Lipidstoffwechsels vorliegen. Auch Träger des Genotyps ε2/ ε3, etwa 6 % der Bevölkerung, profitieren von dieser schutzgebenden ε2-Variante, wobei gleichzeitig das funktionelle ε3-Allel für eine weitgehend normale Rezeptorbindung sorgt. In diesen Fällen ist die LDL-Aufnahme aus dem Blut effizient, und das Risiko für eine LDL-Erhöhung ist deutlich vermindert. Der mit Abstand häufigste Genotyp ist ε3 / ε3, den rund 66 % der Bevölkerung tragen. Diese genetische Konstellation gilt als neutral in Bezug auf das LDL-Cholesterin: Die ApoE-Funktion ist voll intakt, und die Cholesterinaufnahme erfolgt physiologisch. Das bedeutet, dass keine genetische Veranlagung zu erhöhtem LDL besteht, aber gleichzeitig auch kein genetischer Schutz. LDL-Werte werden in diesem Fall hauptsächlich durch Ernährung, Lebensstil und weitere genetische oder hormonelle Einflussfaktoren bestimmt. Der Genotyp ε2/ ε4, der bei etwa 2 % der Bevölkerung auftritt, kombiniert eine schützende (ε2) mit einer potenziell risikobehafteten (ε4) Variante. In der Summe gilt dieser Typ als ausgeglichen, ohne klare genetische Veranlagung für erhöhte LDL-Werte. Die individuelle LDL-Höhe ist bei ε2/ ε4-Trägern in der Regel im Normbereich, kann aber unter ungünstigen Umweltbedingungen leicht ansteigen. Träger des ε3 / ε4 -Genotyps, etwa 24 % der Bevölkerung, haben eine erhöhte genetische Veranlagung für erhöhte LDL-Cholesterinwerte. Das ε4-Allel führt zu einer strukturellen Variante des ApoE-Proteins, die weniger effizient an LDL-Rezeptoren bindet und damit die Remnant-Beseitigung beeinträchtigt. In der Folge kann LDL-Cholesterin im Blut ansteigen, insbesondere bei fettreicher Ernährung oder mangelnder körperlicher Aktivität. Beim seltenen Genotyp ε4/ ε4, der nur etwa 1 % der Bevölkerung betrifft, liegt die ApoE-Variante mit der schwächsten Rezeptorbindung auf beiden Allelen vor. Dies führt dazu, dass die Aufnahme cholesterinhaltiger Lipoproteine in die Leber besonders ineffizient ist. In der Folge verbleibt mehr LDL-Cholesterin im Blut, was zu einem deutlich erhöhten Risiko für Hypercholesterinämie und Atherosklerose.
Die Analyse der Gene APOB, APOE und SREBP2 liefert wertvolle Einblicke in die individuelle genetische Veranlagung zur Regulation von LDL-Cholesterin – einem der wichtigsten kardiometabolischen Risikomarker überhaupt. Gerade bei Patient:innen mit erhöhtem LDL-C, familiärer Vorbelastung, Fettstoffwechselstörungen oder chronischen Entzündungen kann das genetische Profil entscheidende Hinweise darauf geben, wie effizient der Körper Cholesterin transportiert, verwertet, abbaut und wie hoch das langfristige Risiko für arteriosklerotische Prozesse ist.
Auf ernährungsmedizinischer Ebene empfiehlt sich insbesondere eine pflanzenbetonte, mediterran inspirierte Ernährung mit reichlich frischem Gemüse, Hülsenfrüchten, Beeren, Nüssen und hochwertigen Pflanzenölen. Diese Lebensmittel enthalten viele antioxidative sekundäre Pflanzenstoffe, natürliche Ballaststoffe und gesunde Fette, die dazu beitragen, die LDL-Werte zu senken und entzündliche Prozesse im Gefäßsystem zu reduzieren. Gleichzeitig sollte der Konsum von tierischen Fetten, stark verarbeiteten Lebensmitteln, Zucker und Transfetten möglichst eingeschränkt werden, da diese die LDL-Bildung fördern und die LDL-Rezeptoraktivität hemmen können. Auch der gezielte Einsatz von Mikronährstoffen kann dabei helfen, den Cholesterinstoffwechsel zu regulieren. Omega-3-Fettsäuren, insbesondere EPA und DHA, haben sich als entzündungshemmend und Triglycerid-senkend erwiesen und können die LDL-Qualität positiv beeinflussen. Sie stabilisieren die Zellmembranen, wirken blutdrucksenkend und verbessern die Fließeigenschaften des Blutes. Niacin (Vitamin B3) kann in angepasster Dosierung dazu beitragen, die LDL-Werte zu senken und gleichzeitig das schützende HDL-Cholesterin zu erhöhen. Coenzym Q10 unterstützt die zelluläre Energieproduktion, was insbesondere dann wichtig ist, wenn zusätzlich Medikamente wie Statine eingesetzt werden, die den Q10-Spiegel im Körper senken können. Zusätzliche Unterstützung bietet die Einnahme von Pflanzensterinen. Natürlichen Substanzen, die strukturell dem Cholesterin ähneln und dessen Aufnahme im Darm blockieren können. Auch Polyphenole aus grünem Tee, OPC oder Curcumin wirken gefäßschützend, entzündungshemmend und antioxidativ. Begleitend kann auch die Versorgung mit Magnesium, Zink und Vitamin E überprüft und bei Bedarf ergänzt werden, da diese Mikronährstoffe zahlreiche enzymatische Prozesse im Fettstoffwechsel stabilisieren.
Neben der Ernährung spielt auch der Lebensstil eine zentrale Rolle: Regelmäßige körperliche Aktivität, vor allem Ausdauertraining und moderates Krafttraining, fördert nicht nur die LDL-Rezeptordichte auf den Leberzellen, sondern hilft auch, die Leberfettwerte zu normalisieren und Entzündungen zu reduzieren. Schon drei bis vier Trainingseinheiten pro Woche können einen messbaren Effekt auf Blutfettwerte und Gefäßfunktion haben. Auch ausreichend Schlaf, ein bewusster Umgang mit Stress sowie der Verzicht auf Nikotin sind essenzielle Faktoren, die in Verbindung mit genetischer LDL-Veranlagung besonders stark auf den Gesundheitsverlauf einwirken. Zusätzlich können gezielte Formen des Fastens, etwa Intervallfasten oder Dinner-Cancelling, dabei helfen, den Blutzucker zu stabilisieren, die Insulinsensitivität zu verbessern und die körpereigene Cholesterinsynthese zu drosseln. Vorallem wenn eine genetisch bedingte Überaktivität des Cholesterin-regulierenden Systems vorliegt.
Insgesamt ermöglicht das Wissen um die genetische LDL-Veranlagung eine gezielte, alltagsnahe Prävention. Patient:innen gewinnen dadurch mehr Verständnis für ihren Stoffwechsel und erhalten klare, individuelle Empfehlungen, die sie aktiv umsetzen können. So entsteht ein nachhaltiger Gesundheitsgewinn – nicht durch Verzicht, sondern durch gezielte Unterstützung, die auf die tatsächlichen Bedürfnisse des Körpers abgestimmt ist.
Davis, A. J., & Mykkanen, H. (2013). The impact of cholesterol metabolism on cancer progression and therapeutic response. PLoS One, 8(5), e63399. https://doi.org/10.1371/journal.pone.0054155
(https://pmc.ncbi.nlm.nih.gov/articles/PMC3587042/)
Endokrinologikum Aesculabor. (n.d.). Amylase (1.1.1). Retrieved June 2025, from https://www.endokrinologikum-aesculabor.de/leistungsverzeichnis/basislabor/klinische-chemie/amylase-1-1-1.html
National Center for Biotechnology Information. (n.d.). Gene: HMGCR 338. NCBI Gene database. Retrieved June 2025, from https://www.ncbi.nlm.nih.gov/gene?Cmd=DetailsSearch&Db=gene&Term=338
GeneCards. (n.d.). APOB gene: Apolipoprotein B. Retrieved June 2025, from https://www.genecards.org/cgi-bin/carddisp.pl?gene=APOB
National Center for Biotechnology Information. (n.d.). ClinVar: Variant RCV000412515. Retrieved June 2025, from https://www.ncbi.nlm.nih.gov/clinvar/RCV000412515/
SNPedia. (n.d.). APOB. Retrieved June 2025, from https://www.snpedia.com/index.php/APOB
SNPedia. (n.d.). Rs2228314. Retrieved June 2025, from https://www.snpedia.com/index.php/Rs2228314
SNPedia. (n.d.). Rs5742904. Retrieved June 2025, from https://www.snpedia.com/index.php/Rs5742904
Brown, M. S., & Goldstein, J. L. (1997). The SREBP pathway: Regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell, 89(3), 331-340. https://doi.org/10.1016/S0092-8674(00)80134-5
(https://pmc.ncbi.nlm.nih.gov/articles/PMC289165/)
Brown, M. S., & Goldstein, J. L. (2014). SREBPs: The interplay between membrane biogenesis and metabolism. FEBS Journal, 281(21), 4381-4393. https://doi.org/10.1111/febs.12721
(https://febs.onlinelibrary.wiley.com/doi/10.1111/febs.12721)
GeneCards. (n.d.). SREBF2 gene: Sterol regulatory element binding transcription factor 2. Retrieved June 2025, from https://www.genecards.org/cgi-bin/carddisp.pl?gene=SREBF2
Horton, J. D., Goldstein, J. L., & Brown, M. S. (2008). SREBPs: Activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation, 122(9), 2687-2695. https://doi.org/10.1172/JCI36448
(https://pmc.ncbi.nlm.nih.gov/articles/PMC2908458/)
Horton, J. D., Shah, N. A., Warrington, J. A., Anderson, N. N., Park, S. W., Brown, M. S., & Goldstein, J. L. (2003). Combined analysis of oligonucleotide microarray data from transgenic and knockout mice identifies direct SREBP target genes. The Journal of Clinical Investigation, 112(11), 1760-1770. https://doi.org/10.1172/JCI200318378
(https://dm5migu4zj3pb.cloudfront.net/manuscripts/2000/2181/JCI9802181.pdf)
Hsu, J. W., & et al. (2014). Regulation of cholesterol homeostasis by SREBPs: Implications for metabolic diseases. The Journal of Clinical Investigation, 124(2), 452-460. https://pubmed.ncbi.nlm.nih.gov/24943010/
Liu, Y., Ma, M., & Wang, X. (2022). Role of SREBPs in lipid metabolism and metabolic diseases. Signal Transduction and Targeted Therapy, 7, Article 197. https://doi.org/10.1038/s41392-022-01125-5
(https://www.nature.com/articles/s41392-022-01125-5)
National Center for Biotechnology Information. (2021). Sterol regulatory element-binding proteins. In StatPearls. Treasure Island (FL): StatPearls Publishing. Retrieved June 2025, from https://www.ncbi.nlm.nih.gov/books/NBK570370/
Novus Biologicals. (n.d.). SREBP2 regulating cholesterol homeostasis and lipid metabolism. Retrieved June 2025, from https://www.novusbio.com/antibody-news/antibodies/srebp2-regulating-cholesterol-homeostasis-and-lipid-metabolism?srsltid=AfmBOoojYcuM_l-ZKktREXd_Kjscub31fmvYTaxqNnJX7FlYfY6KHYh2
Pathak, P., & Basak, S. (2020). SREBP2 and cholesterol metabolism in cancer. eBioMedicine, 58, 102924. https://doi.org/10.1016/j.ebiom.2020.102924
(https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964%2820%2930330-3/fulltext)
UniProt Consortium. (n.d.). P04114 (SREBF2_HUMAN) – Sterol regulatory element-binding protein 2. UniProt. Retrieved June 2025, from https://www.uniprot.org/uniprotkb/P04114/entry?utm_source=chatgpt.com
Wang, Y., & et al. (2021). Role of SREBP2 in lipid metabolism and nonalcoholic fatty liver disease. Biochimica et Biophysica Acta (BBA) – Molecular and Cell Biology of Lipids, 1866(1), 158854. https://doi.org/10.1016/j.bbalip.2020.158854
(https://www.sciencedirect.com/science/article/pii/S0022227520353001)
Wang, H., & et al. (2016). SREBP2-mediated cholesterol metabolism promotes hepatocellular carcinoma progression. Oncotarget, 7(33), 53548-53559. https://doi.org/10.18632/oncotarget.10608
(https://pmc.ncbi.nlm.nih.gov/articles/PMC4766982/)
Wang, L., Zhao, L., & et al. (2023). Cholesterol metabolism and cardiovascular diseases: The role of SREBPs. Lipids in Health and Disease, 22(1), Article 125. https://doi.org/10.1186/s12944-023-01869-1
(https://lipidworld.biomedcentral.com/articles/10.1186/s12944-023-01869-1)
Xu, S., & et al. (2023). SREBP2 in tumor metabolism and immunity: Advances and prospects. Experimental Cell Research, 425, 113481. https://doi.org/10.1016/j.yexcr.2023.113481
(https://www.sciencedirect.com/science/article/pii/S1043276023000929)
Zhang, X., Zhu, M., Lu, Q., & et al. (2016). SREBP2 regulates cholesterol biosynthesis and impacts cell proliferation. Scientific Reports, 6, 18184. https://doi.org/10.1038/srep18184
(https://www.nature.com/articles/srep18184)
DocCheck Flexikon. (n.d.). Apolipoprotein E. Retrieved June 2025, from https://flexikon.doccheck.com/de/Apolipoprotein_E